
分析 根据“NaClO3与盐酸反应生成二氧化氯和氯气”及质量守恒定律可知反应物为NaClO3、HCl,生成物为ClO2、Cl2、H2O、NaCl,据此写出化学方程式,再改写成离子方程式.
解答 解:根据题干信息可知,NaClO3与盐酸反应生成二氧化氯和氯气,根据质量守恒定律,钠离子反应后会生成氯化钠,H元素会转化成水,该反应的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl,改写成离子方程式为:,
故答案为:2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O.
点评 本题考查了离子方程式的书写,题目难度中等,明确发生反应原理为解答关键,注意掌握离子方程式书写原则,试题培养了学生的分析能力及灵活应用基础知识的能力.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2O2 $\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | |
| B. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | |
| C. | 2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 | |
| D. | Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、空气、醋酸、干冰 | B. | 冰醋酸、碱石灰、硫酸钠、乙醇 | ||
| C. | 蛋白质、油脂、苛性钠、石灰石 | D. | 胆矾、漂白粉、氯化钾、硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体.
,结构式为?O=C=O?,其分子内σ键与π键的个数比为?1:1,其晶体类型为分子晶体. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
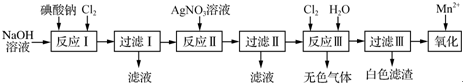
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
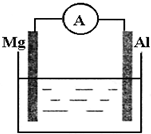 如图所示装置
如图所示装置 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com