
【题目】甲醇汽油是一种新能源清洁燃料,可以作为汽油的替代物。有关反应的热化学方程式如下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)= H2O(l)△H=-44kJ/mol
I.写出CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:_________________。
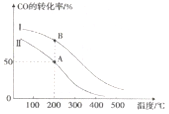
II. 工业上可用CO和H2制取甲醇:CO(g)+2H2(g)=CH3OH(g) △H=akJ/mol。为研究该反应平衡时CO转化率与反应物投料比(反应物投料比=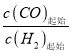 )以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
)以及温度的关系,研究小组在10L的密闭容器中进行模拟反应,并依反应数据绘出下图:
回答下列问题:
(1)反应热a____0(填“>”或“<”),判断理由是______。
(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①反应物投料比I_____II(填“>”或“<” 或“=”)。
②若按曲线II反应,n(CO)起始=10mol,反应物投料比=0.5,则A点的平衡常数(Ka)值为____,B点的平衡常数(Kb)值为________________。
(3)为提高CO的转化率,除了可以适当改变反应物与生成物的浓度外,还可以采取的措施有:________________、_______________。
【答案】 CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ/mol < 升高温度,CO的转化率降低,平衡左移,所以正反应为放热反应。a<0 < 1 1 降低温度 增大压强
【解析】试题分析:I.根据盖斯定律计算CH3OH(l)不完全燃烧生成CO和H2O(l)的焓变; II. (1).升高温度,转化率降低,平衡逆向移动;相同温度下,增大氢气浓度,平衡正向移动,CO的转化率增大。降低温度或 增大压强都能使平衡正向移动。
解析:I.根据盖斯定律,①÷2-②÷2+③×2得CH3OH(l)不完全燃烧生成CO和H2O(l)的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-442.8kJ/mol;II.(1)升高温度,转化率降低,平衡左移,所以正反应为放热反应,反应热a<0;(2)在其他条件相同,曲线I、II分别表示反应物投料比不同时的反应过程曲线。
①增大氢气浓度,平衡正向移动,CO的转化率增大,所以 反应物投料比I<II;
反应物投料比I<II;
②

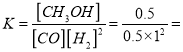 1
1
A、B两点的温度相同,相同温度下平衡常数相同,故B点的平衡常数为1;
(3)为提高CO的转化率,可以让平衡正向移动,采取的措施有:降低温度、增大压强。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】下列物质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4 ⑨CO2;⑩酒精溶液(均填写编号回答)
(1)是弱电解质的有 ,是非电解质的有 。
(2)有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为 ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是 。
(3)某温度时,1 molL-1的醋酸溶液电离平衡常数为1.0×10 -8,达平衡时,溶液中氢离子浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【全国省级联考.东北三省四市教研联合体2017届高三高考模拟试题(一)】下列说法正确的是
A. KAl(SO4)2溶液中 c(K+)= 2c(SO42-)
B. 向NaHCO3溶液中加入少量 Ba(OH)2固体,c(CO32-)增大
C. 含有AgCl和AgBr固体的悬浊液中,C(Ag+)>c(Cl-) =c(Br-)
D. 常温下,向含0.1molCH3COOH的溶液中加入amolNaOH固体,反应后溶液中c(CH3COOH) =c(CH3COO-),则溶液显碱性。(已知醋酸Ka =1.75×10-5 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用直流电电解下列各溶液一段时间后,溶液的颜色和密度保持不变的是
A. 用铜电极电解稀H2SO4 B. 用石墨电极电解Na2SO4溶液
C. 用铜电极电解CuCl2溶液 D. 铁为阳极,锌为阴极,电解ZnCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·安徽理综,11,6分)室温下,下列关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O![]() )+2c(H2C2O4)
)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO![]() )+c(OH-)
)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,下列能大量共存的离子组是
A. S2O32-、Na+、Cl-、K+ B. Na+、Mg2+、Cl-、SO42-
C. Ba2+、Na+、SO42-、OH- D. K+、H2H5OH、MnO4-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下在固定容器中进行的可逆反应2M(g)+N(g)![]() Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
Q(g) △H>0,达到平衡状态,若升高温度,则对于该混合气体下列说法正确的是( )
A.密度增大 B.平均相对分子质量增大 C总分子数增大 D.平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表第三周期中,置换酸中氢能力最强的元素的元素符号为_____,最高价氧化物对应水化物的酸性最强的化合物的化学式是__________,碱性最强的化合物的化学式是__________,显两性的氢氧化物的化学式是__________,该两性氢氧化物与盐酸、氢氧化钠溶液分别反应的离子方程式为__________________、_________________,原子半径最大的金属元素的名称是________,离子半径最小的离子结构示意图是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com