
����Ŀ�����ӷ�Ӧ��������ԭ��Ӧ������ѧ��ѧ����Ҫ�ķ�Ӧ���͡���ش��������⣺
(1)�ڷ������ӷ�Ӧ�ķ�Ӧ����������У�һ��������_____________��
A������ B�������� C������� D���� E��������
(2)���dz���ͼʾ�ķ�����ʾ��ͬ��Ӧ����֮��Ĺ�ϵ����ֽⷴӦ��������ԭ��Ӧ�ɱ�ʾΪ��ͼ����ͼΪ���ӷ�Ӧ��������ԭ��Ӧ���û���Ӧ����֮��Ĺ�ϵ�����ʾ���ӷ�Ӧ��������ԭ��Ӧ���û���Ӧ����ĸ������_____________

(3)��NaBr��Һ����AgC1�����У�����AgBr��ɫ�����������ӷ�Ӧ����������������AgCl��AgBr��Ƚϣ��ܽ�Ƚϴ����_____________��
(4)��֪ij������ԭ��ӦAu2O3 + 4Na2S2O3 + 2H2O ��Au2O+ 2Na2S4O6 +4NaOH
�� �õ����ű������ת�Ƶķ������Ŀ________________��
�� ��Ӧ�У���������Ԫ����______________����������_________________��
�� �Ƚϸ÷�Ӧ����������������������������ǿ��_________________________��
���𰸡�C��E C A B AgCl 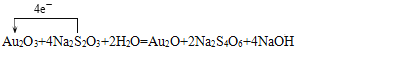 S ���� Au2O3 Na2S4O6 ��Au2O3 �� Au2O3 �� Na2S4O6
S ���� Au2O3 Na2S4O6 ��Au2O3 �� Au2O3 �� Na2S4O6
��������
����������ԭ��Ӧ�ı��ʺ��������������ݵ����ŵĻ��ƹ��ɷ��������ݻ�ѧ��Ӧ�����ͷ��������
(1)���ӷ�Ӧ�������Ӳμӵķ�Ӧ�������������ǻ�������һ���������±��������ܷ�Ӧ�����ӣ��ʴ�Ϊ��CE��
(2) �û���Ӧһ���л��ϼ۵�������һ������������ԭ��Ӧ����B�����û���Ӧ����A����������ԭ��Ӧ��������֪CΪ���ӷ�Ӧ����ǰ���߾��н��档�ʴ�Ϊ��C�� A�� B��
(3) ���ݳ����ܽ�ƽ����ɣ�����������ɸ����ܵ����ʣ��ɵõ���AgBr���ܽ��С��AgCl���ʴ�Ϊ��AgCl��
(4) Au��+3�۽���+1�����õ����ӹ�Au2O3��������������ԭ����Au2O���ʻ�ԭ����ΪAu2O��Na2S4O6��S��ƽ�����ϼ�Ϊ+ ![]() ����Na2S2O3����ԭ��������������Na2S4O6����Na2S4O6�������������S���������������ɻ�ԭ��ָ���������������ԣ�������>���������ԭ�ԣ���ԭ��>��ԭ����ʴ�Ϊ��
����Na2S2O3����ԭ��������������Na2S4O6����Na2S4O6�������������S���������������ɻ�ԭ��ָ���������������ԣ�������>���������ԭ�ԣ���ԭ��>��ԭ����ʴ�Ϊ��
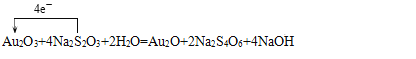 �� S ����Au2O3��Na2S4O6 ��Au2O3��
�� S ����Au2O3��Na2S4O6 ��Au2O3��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��Ŵ�����ʪ����ͭ�ļ��������������Ϊͭ������ӦΪFe + CuSO4 = Cu + FeSO4���йظ÷�Ӧ��˵����ȷ���ǣ� ��
A.Fe����ԭB.Fe�ǻ�ԭ��C.CuSO4����������ӦD.CuSO4ʧȥ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ص�ԭ�������ֻ��һ�����ӣ�����VIIA��Ԫ�ؽ��ʱ�γɵĻ�ѧ��
A.һ���ǹ��ۼ�B.һ�������Ӽ�
C.�����ǹ��ۼ���Ҳ���������Ӽ�D.����˵��������ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ˮ������ѧ��Ӧ��ʹ��ˮ��ɫ����
A.�Ҵ�B.��ϩC.��D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ��������Na2O���ʵ�Na2O2����������ͼ��ʾ��ʵ��װ�òⶨNa2O2�����Ĵ���(ͨ��CO2����Ʒ��Ӧ������O2�����ⶨNa2O2�ĺ���)��(�ɹ�ѡ�õķ�Ӧ�CaCO3���塢6 mol��L-1���ᡢ6 mol��L-1���������ˮ)

�ش��������⣺
(1)ʵ��ǰ������_________��
(2)װ��A��Һ���Լ�Ӧѡ��_____��
(3)װ��B��������_________��װ��C��������____��װ��E�м�ʯ�ҵ�������__________��
(4)װ��D�з�����Ӧ�Ļ�ѧ����ʽ��___________��
(5)����ʼʱ�����Ʒ������Ϊ2.0 g����Ӧ���������������Ϊ224 mL(��״��)����Na2O2�����Ĵ���Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ����Ҫ�Ĺ���Ԫ�أ�������ƻ������������Ҫ���ϣ������ƾ���(Na2MoO4��2H2O)��һ����Ҫ�Ľ�����ʴ����ij�����������(��Ҫ�ɷ�MoS2)Ϊԭ��ұ��������������ƾ������Ҫ����ͼ���£�
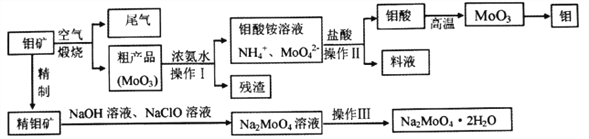
��1��Na2MoO4��2H2O��Ԫ�صļ�̬Ϊ_________����ҵ��������β���ù����İ�ˮ��������Ӧ�����ӷ���ʽΪ________________________________________________��
��2����ͼ����Ϣ�����ж�MoO3��____________�����(������������������������������)
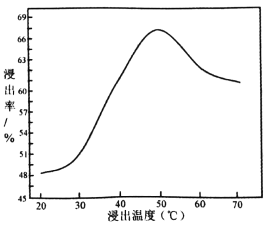
��3������ NaClO���������ķ�������ʯ�е���������ù��̷��ȣ��仯ѧ��ӦΪ��NaClO+MoS2+NaOH��Na2MoO4+Na2SO4+NaCl+H2O���÷�Ӧ��ƽ�� NaClO��MoS2��ϵ����Ϊ____________�������¶����ߣ���Ľ����ʵı仯��ͼ������50��������ʽ��͵Ŀ���ԭ����____________________________________(д����)��
��4����������Ҫ����____________�����������õ�����Ҫˮϴ�����������Ƿ�ϴ�Ӹɾ��ķ�����____________________________________��
��5��﮺�MoS2�ɳ���صĹ���ԭ��ΪxLi+nMoS2![]() Li(MoS2)n�����س��ʱ�����ϵĵ缫��ӦʽΪ______________________��
Li(MoS2)n�����س��ʱ�����ϵĵ缫��ӦʽΪ______________________��
��6��ij������1.00��103�ִ����(��MoS216.00%)�Ʊ��ⵥ�ʣ���֪ұ�������У���������Ϊ10.00%�������յõ��ⵥ������Ϊ___________�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������H++OH��=H2O����ʾ�Ļ�ѧ��Ӧ�ǣ�������
A.������þ��ϡ���ᷴӦ
B.Ba��OH��2��Һ����ϡ������
C.����ʯ��ˮ��ϡ���ᷴӦ
D.������̼ͨ�����ʯ��ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڱ仯�����У�ֻ��˷����Ӽ�����������
A.ʳ���ۻ�B.�ɱ�����
C.�Ȼ�����ȣ�������ʧD.�Ȼ�������ˮ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com