
| A. | 硅酸钠可用作木材防火涂料 | B. | Fe2O3可用作外墙涂料 | ||
| C. | 过氧化钠可用作潜艇供氧剂 | D. | 铝制容器可以贮运稀硝酸 |
分析 A.硅酸钠可用于阻燃剂;
B.Fe2O3为红色固体;
C.过氧化钠与二氧化碳或水反应生成氧气;
D.Al与稀硝酸反应生成硝酸铝、NO和水.
解答 解:A.硅酸钠可用于阻燃剂,用硅酸钠浸泡的木材可防火,故A正确;
B.Fe2O3为红色固体,则Fe2O3可用作外墙涂料,故B正确;
C.过氧化钠与二氧化碳或水反应生成氧气,则过氧化钠可用作潜艇供氧剂,故C正确;
D.Al与稀硝酸反应生成硝酸铝、NO和水,则不能用铝制容器贮运稀硝酸,可储运浓硝酸,故D错误.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型和高频考点,侧重于基础知识的理解和运用的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 甲装置为铁的析氢腐蚀,若将铁换成铜,则甲装置就是铜的吸氧腐蚀 | |
| B. | 若将甲装置中的电流表改为电源,无论电源怎么连接,C电极上都会有气体放出 | |
| C. | 乙装置中K关闭后,a极附近颜色逐渐加深变黑 | |
| D. | 若将乙装置中的NaOH溶液换为HCl溶液,则K关闭后b极颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| B. | 合成纤维是利用自然界的纤维材料通过化学合成方法得到的 | |
| C. | 研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果 | |
| D. | 碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
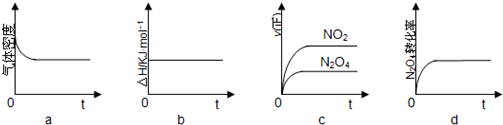
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com