

| 时间 N2的转化率 温度 | 1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
分析 (1)根据盖斯定律来求反应的焓变,然后根据反应放出的热量与物质的量成正比;
(2)该反应为气体体积减小的放热反应,改变条件在达到新平衡的过程中正反应速率始终增大,则应为正逆反应速率都增大,且平衡向逆反应方向移动,据此答题;
(3)①根据温度升高化学平衡向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
③根据a、b、c三点所表示的意义来回答;
③根据反应物的物质的量之比为等于化学计量数之比时,达平衡状态时生成物的百分含量最大;根据化学平衡状态是反应物的转化率最大、生成物的产率最大来回答;先求出各自的平衡浓度,然后根据平衡常数的概念来回答;
(4)根据T1和T2同时间段内N2的转化率可知T2反应温度低,N2(g)+3H2(g)═2NH3(g)△H<0,正反应为放热反应,所以T2相当于T1达到平衡时降温,平衡向正反应方向移动,达平衡时,N2的转化率较T1时高,但温度低,反应速率慢,据此判断;
(5)T1温度下2mol N2和4mol H2在1L容器中反应,3小时达平衡,与(4)中T1温度下的数据比较可知,起始反应物浓度为原来的2倍,则平衡向正反应方向移动,N2的转化率要高于(4)中T1温度下的数据,据此画图.
解答 解:(1)N2(g)+O2(g)═2NO(g)△H=+akJ/mol ①
N2(g)+3H2(g)═2NH3(g)△H=-bkJ/mol ②
2H2(g)+O2(g)═2H2O(g)△H=-ckJ/mol ③
由盖斯定律①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=(2a-2b+3c)kJ/mol;
则34g 即2mol氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为$\frac{1}{2}$×(2a-2b+3c) kJ,
故答案为:$\frac{1}{2}$(2a-2b+3c) kJ;
(2)该反应为气体体积减小的放热反应,改变条件在达到新平衡的过程中正反应速率始终增大,则应为正逆反应速率都增大,且平衡向逆反应方向移动,所以改变条件应为升温,反应速率增大,平衡逆向移动,而加压、增大c(N2)、降低c(NH3)平衡都正向移动,故选A;
(3)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2反应物氨气的分数增加,故T1>T2,
故答案为:<;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大,
故答案为:c;
③当氮气和氢气的物质的量之比为1:3时达平衡状态时氨的百分含量最大,平衡点时产物的产率最大,据图示,当起始氢气的物质的量为0.15mol时氨的含量最大,故起始加入N2的物质的量为0.05mol,所以起始时氮气的浓度是0.05mol/l,
故答案为:0.05;
(4)根据T1和T2同时间段内N2的转化率可知T2反应温度低,N2(g)+3H2(g)═2NH3(g)△H<0,正反应为放热反应,所以T2相当于T1达到平衡时降温,平衡向正反应方向移动,达平衡时,N2的转化率较T1时高,所以a>80%,但温度低,反应速率慢,所以T2时反应可能达到平衡也可能未达平衡,所以a=b或a<b,所以80%<a=b或80%<a<b,
故答案为:80%<a=b或80%<a<b;
(5)T1温度下2mol N2和4mol H2在1L容器中反应,3小时达平衡,与(4)中T1温度下的数据比较可知,起始反应物浓度为原来的2倍,分别为2mol/L 和4mol/L,则平衡向正反应方向移动,N2的转化率要高于(4)中T1温度下的数据,所以平衡时N2的物质的量浓度小于2mol/l-80%×2mol/l=0.4mol/l,NH3的物质的量浓度大于2×80%×2mol/l=3.2mol/l,据此画出图为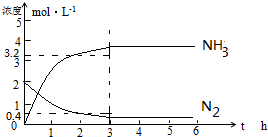 ,
,
故答案为: .
.
点评 本题主要考查了盖斯定律、化学平衡常数、外界条件对反应速率和平衡的影响,难度中等,根据课本知识即可完成.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 蒸馏法分离混合物时,冷凝管下口进水,上口出水 | |
| B. | 分离CCl4和H2O的混合物时,CCl4从分液漏斗下口放出 | |
| C. | 蒸干NaCl溶液制NaCl晶体 | |
| D. | 不能用酒精萃取碘水中的I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钙 | B. | 磷 | C. | 铁 | D. | 碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 min内用O2表示的反应速率为0.12 mol/(L•min) | |
| B. | 该反应的平衡常数数值为7.5 | |
| C. | SO2的平衡转化率为60% | |
| D. | 加入催化剂,可使△H变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、氯水、液氯是同一种物质,只是状态不同 | |
| B. | 氯气不能溶于水,所以可以用排水法收集 | |
| C. | 氯气是一种黄绿色、有刺激性气味的气体 | |
| D. | 用自来水配制AgNO3溶液时,药品不会变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤②④③ | B. | ①③⑤④② | C. | ③①⑤②④ | D. | ⑤②①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com