
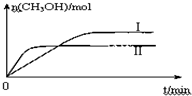
 某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |
| c(CH3OH).c(H2O) |
| c(CO2).c3(H2) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用盐酸冲洗 |
| C、用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 4 |
| H+ |
| ①转化 |
2- 7 |
| fe2+ |
| ②还原 |
| 沉淀剂a |
| ③沉淀 |
| A、第①步当2c (Cr2O72-)=c(CrO42-)时,达到了平衡状态 |
| B、对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C、Cr(OH)3是一种两性氢氧化物,所以像Al(OH)3一样能溶于氨水和碳酸溶液中 |
| D、第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、互为同分异构体 |
| B、都是天然有机高分子化合物 |
| C、遇碘(I2)均会呈蓝色 |
| D、在人体内均会发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com