
| A、常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA |
| B、5.6 g铁与500 mL 2 mol?L-1硝酸反应,转移的电子数为0.2NA |
| C、常温常压下,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
| D、V La mol?L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
| m |
| M |
| 8.8g |
| 44g/mol |
| m |
| M |
| 5.6g |
| 56g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O |
| B、Zn |
| C、KI |
| D、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验操作 | |
| A | 实验室制备硝基苯 | 将苯和浓硝酸混合后加热 |
| B | 除去硫酸钠溶液中少量氯化钠杂质 | 向含有氯化钠杂质的硫酸钠溶液中加入适量的硝酸银溶液,过滤 |
| C | 检验溴乙烷发生消去反应的产物 | 向盛有少量溴乙烷的试管中,先加入氢氧化钠溶液,再滴入用硝酸酸化的硝酸银溶液 |
| D | 浓硝酸的氧化性强于稀硝酸 | 向盛有少量的浓硝酸、稀硝酸的两支试管中,分别加入大小相同的铜片 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
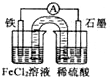
| A、原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 |
| B、此电池工作原理与硅太阳能电池工作原理相同 |
| C、Fe为正极,石墨上发生的反应为:2H++2e-═H2↑ |
| D、若装置中的盐桥用铁丝代替,电流表指针无偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
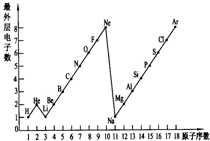 图表是整理数据、发现其中规律的一种重要工具.1~18号元素原子最外层电子数与原子序数的关系如图.试回答:
图表是整理数据、发现其中规律的一种重要工具.1~18号元素原子最外层电子数与原子序数的关系如图.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com