
【题目】(1)利用某些有机物之间的相互转换可以贮存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)的反应为
 △H=+88.62 kJ/mol
△H=+88.62 kJ/mol
以下叙述错误的是________(填序号)
a.NBD的能量比Q的能量高 b.NBD和Q互为同分异构体
c.NBD的分子式为C7H8 d.NBD能使溴水褪色
e. NBD及Q的一氯代物均为三种
(2)如图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是______。

a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某研究性学习小组欲研究影响锌和稀硫酸反应速率的外界条件,下表是其实验设计的有关数据:

①在此5组实验中,判断锌和稀硫酸反应速率大小,最简单的方法可通过定量测定锌完全消失所需的时间进行判断,其速率最快的实验是_____(填实验序号)。
②对锌和稀硫酸反应,实验1和2表明,____对反应速率有影响,实验1和3表明,____对反应速率有影响
③进行实验2时,小组同学根据实验过程绘制的标准状况下的气体体积V与时间t的图像如图所示。在OA、AB、BC三段中反应速率最快的是_______,2~4min内以硫酸的浓度变化表示的反应速率(假设溶液的体积不变)=_____。

【答案】a a c e 5 固体反应物的表面积 形成原电池 AB 0.06mol·L-1·min-1
【解析】
(1)△H>0,为吸热反应,结合原降冰片二烯(NBD)和四环烷(Q)的结构分析判断;
(2)充入一定量的NO2气体后,发生反应2NO2(g)N2O4(g),当正逆反应速率相等时平衡达平衡,据此分析解答;
(3)根据影响化学反应速率的因素结合实验数据分析解答①和②;③根据图像,计算各时间段内生成氢气的体积判断,根据氢气的体积计算出消耗的硫酸的物质的量,再结合v=![]() 计算速率。
计算速率。
(1)a.△H>0,说明反应物(NBD)的总能量小于生成物(Q)的总能量,故a错误;b.二者分子式相同,但结构不同,属于同分异构体,故b正确;c.由结构简式可知分子中能够含有7个C、8个H,则分子式为C7H8,故c正确;d.NBD结构中含有C=C,能够与溴发生加成反应,使溴水褪色,故d正确;e. NBD及Q的一氯代物均为三种,如图 、
、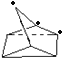 ,故e正确;故答案为:a;
,故e正确;故答案为:a;
(2)a.t1时,正反应速率大于逆反应速率,则反应未达到平衡,反应向正反应方向进行,所以NO2浓度在减小,故a正确;b.t2时,正逆反应速率相等,反应达平衡状态,化学平衡为动态平衡,反应没有停止,故b错误;c.t2~t3,为平衡状态,各物质浓度不再变化,故c正确;d.t2~t3,正逆反应速率相等,反应达平衡状态,各物质浓度不再变化,但浓度不一定相等,故d错误;e.0~t2,正反应速率大于逆反应速率,反应未达到平衡,反应向正反应方向进行,所以N2O4浓度增大,故e正确;f.反应过程中,N2O4浓度增大,气体的颜色变浅,故f错误;故答案为:ace;
(3)①第5组实验时温度最高,浓度最大,也滴加了硫酸铜溶液,利用了Zn-Cu原电池反应,因此反应速率最快,锌完全消失所需的时间最短,故答案为:5;
②实验1和2除固体表面积不同外,其它因素相同,说明固体反应物的表面积对速率有影响,实验3比1多了形成Zn-Cu原电池反应,说明形成原电池也会影响化学反应速率,故答案为:固体反应物的表面积;形成原电池;
③从图中看出2-4分钟内产生氢气最多,故这段时间内反应速率最大;2-4分钟内,产生氢气179.2-44.8=134.4mL,物质的量为![]() =6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为6×10-3mol,则v(H2SO4)=
=6×10-3mol,根据反应方程式:Zn+H2SO4=ZnSO4+H2↑可知,参加反应硫酸的物质的量为6×10-3mol,则v(H2SO4)=![]() =
= =0.06molL-1min-1,故答案为:AB;0.06molL-1min-1。
=0.06molL-1min-1,故答案为:AB;0.06molL-1min-1。


科目:高中化学 来源: 题型:
【题目】下列化合物中,既不能与NaOH溶液发生反应,又不能与溴的CCl4溶液反应,也不能使酸性KMnO4溶液褪色的是
A.丙烷B.乙醇
C.乙酸D.丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志。
I.将8.96L (标准状况)乙烯和乙烷的混合气体通入足量的溴的四氯化碳溶液中,充分反应,溴的四氯化碳溶液的质量增加8.4g,则原气体混合物中乙烯与乙烷的物质的量之比为______________。
II.已知乙烯能发生以下转化:
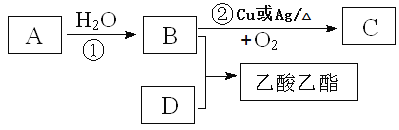
⑴写出B、D化合物中官能团的名称:B____________________;D___________________;
⑵写出相关反应的化学方程式:
①_________________________________ 反应类型:________________
②__________________________________ 反应类型:_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,在生产、生活中应用广泛,外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组通过如下装置(夹持及加热装置略去)制取NaNO2样品并对样品含量进行测定
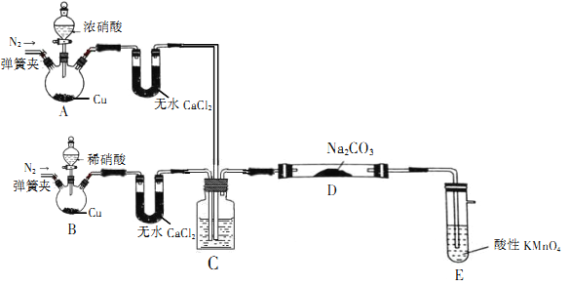
该小组先查阅资料知:NO、NO2能被酸性高锰酸钾氧化为NO3-。
(1)装置A中用于盛放浓硝酸的仪器名称为__________,装置D中发生的化学反应方程式为___________。
(2)①装置C中所装的液体需满足的条件是____________________。
②其作用为____________________。
(3)装置E的作用是____________________。
(4)为测定制得样品中NaNO2的含量,该实验中需配制KMnO4标准溶液并酸化,应选择__________(填化学式)来酸化KMnO4溶液。
(5)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0g样品溶于水配制成250mL溶液,取25.00mL溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液进行滴定,消耗20.00mL酸性KMnO4溶液(杂质不反应)。滴定过程中酸性KMnO4溶液的作用是____________________,所得样品中NaNO2的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.测得CO的平衡转化率与压强的关系如图所示。有关说法正确的是( )
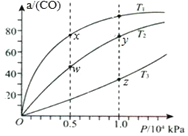
A. 混合气体密度:ρ(x)>ρ(w) B. 正反应速率:v正(y)>v正(w)
C. 反应温度:T2>T3 D. 混合气体的平均摩尔质量:M(y)<M(z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯酚的叙述中,正确的是 ( )
A.纯净的苯酚是粉红色晶体B.苯酚不溶于水
C.苯比苯酚容易发生苯环上的取代反应D.可用浓溴水鉴别苯和苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源;乙是利用装置甲模拟工业电解法来处理含Cr2O72-废水,电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。当电池工作时,下列说法错误的是

A. 甲中H+透过质子交换膜由左向右移动
B. 乙池中Fe棒应与甲池中的M极相连
C. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
D. 若溶液中减少了0.OlmolCr2O72-,则电路中至少转移了0.06 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的NaCl溶液,但手边只有混有Na2SO4、NaHCO3的NaCl。某学生设计了如图所示方案提取纯净的NaCl溶液。

如果此方案正确,那么:
(1)操作④为________,操作①、④、⑤都用到的玻璃仪器有____________。
(2)操作②为什么不用硝酸钡溶液,其理由是___________________________________。
(3)进行操作②后,如何判断SO42-已除尽,方法是_______________________________。
(4)操作③的目的是____________,为什么不先过滤后加碳酸钠溶液?理由是____________。
(5)操作⑤的目的是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com