
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | NaHCO3溶液中,c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-) | |
| B. | 将amol•L-1HCN溶液与amol•L-1NaOH溶液等体积混合后,测得所得溶液显碱性,则c(CN-)>c(Na+) | |
| C. | 等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) | |
| D. | 1.0 mol•L-1Na2CO3溶液:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
分析 A.HCO3-水解生成H2CO3、OH-,且水电离生成OH-;
B.等体积混合后,生成NaCN,测得所得溶液显碱性,可知CN-水解显碱性;
C.由表格中Ka可知酸性,酸性越弱,对应盐的水解程度越大;
D.由化学式可知,n(Na)=2n(C),结合物料守恒分析.
解答 解:A.HCO3-水解生成H2CO3、OH-,且水电离生成OH-,则c(OH-)>c(H2CO3),故A错误;
B.等体积混合后,生成NaCN,测得所得溶液显碱性,可知CN-水解显碱性,则c(CN-)<c(Na+),故B错误;
C.由表格中Ka可知酸性为CH3COOH>HCN>HCO3-,则等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故C正确;
D.由化学式可知,n(Na)=2n(C),由物料守恒可知Na2CO3溶液中$\frac{1}{2}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故D错误;
故选C.
点评 本题考查弱电解质的电离平衡,为高频考点,把握盐类水解、酸性与水解的关系、物料守恒为解答本题关键,侧重分析与应用能力的考查,注意选项A为解答的难点,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
 .
. 、
、 、
、 ;其中有一种分子中,所有碳原子一定在同一平面内,它发生加聚反应的化学方程式为
;其中有一种分子中,所有碳原子一定在同一平面内,它发生加聚反应的化学方程式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )
298K时,在20.0ml0.10mol/L氨水中滴入0.10mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol/L氨水的电离度为1.32%,下列有关叙述不正确的是( )| A. | 该滴定过程应该选择甲基橙作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 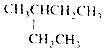 2-乙基丁烷 2-乙基丁烷 | B. | CH3CHBr2 二溴乙烷 | ||
| C. | 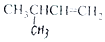 2-甲基丁烯 2-甲基丁烯 | D. |  苯甲醇 苯甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质和油脂一定条件下都能水解 | |
| B. | 乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 与有机物 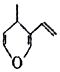 互为同分异构体,且能与NaOH溶液反应的化合物有7种 互为同分异构体,且能与NaOH溶液反应的化合物有7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )
氨分子中的一个氢原子被甲基取代后,所得甲胺(CH3NH2)的性质与氨相似,CH3NH2•H2O也是一元弱碱,25℃时电离常数Kb=4.0×10-5.现用0.0500mol/L的稀硫酸滴定l0mL 0.1000mol/L的甲胺溶液,溶液中c(OH-)的负对数(pOH)与所加稀硫酸的体积(V)的关系如图所示.下列说法正确的是( )| A. | 甲胺在水中的电离方程式为:CH3NH2•H2O═CH3NH3++OH- | |
| B. | A、B、C三点溶液中,水电离出来的c(H+):B>C>A | |
| C. | C点所在溶液中$\frac{c(C{H}_{3}N{H}_{2}•{H}_{2}O)}{c(C{H}_{3}N{H}_{3}^{+})}$=2.5×10-5 | |
| D. | B点溶液中存在c(CH3NH2•H2O)>c(CH3NH3+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:①>④=②>③ | |
| B. | 将NH4HCO3、AlCl3、FeCl2、KAl(SO4)2的溶液分别加热蒸干、灼烧,均不能得到原物质 | |
| C. | 可直接根据Ksp的数值大小比较难溶物在水中的溶解度大小 | |
| D. | 25℃时,Ksp(AgCl)>Ksp(AgI),向AgCl的悬浊液中加入KI固体,有黄色沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com