
| A. | pH=3的硝酸跟pH=11的氢氧化钡溶液 | |
| B. | pH=3的盐酸跟pH=11的氨水 | |
| C. | pH=3硫酸跟pH=11的氢氧化钠溶液 | |
| D. | pH=3的醋酸跟pH=11的氢氧化钠溶液 |
分析 根据酸碱的强弱判断溶液中n(H+)与n(OH-)关系进行判断和计算.
解答 解:A、pH=3的硝酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钡溶液中c(OH-)=1×10-3mol/L,在室温下等体积混合后,pH=7,故A错误;
B、pH=3的盐酸中c(H+)=1×10-3mol/L,pH=11的氨水中c(OH-)=1×10-3mol/L,由于氨水为弱碱,则氨水过量,在室温下等体积混合后,pH>7,故B错误;
C、pH=3的硫酸中c(H+)=1×10-3mol/L,pH=11的氢氧化钠溶液中c(OH-)=1×10-3mol/L,在室温下等体积混合后,pH=7,故C错误;
D、pH=3的醋酸跟pH=11的氢氧化钠溶液等体积混合后时,CH3COOH的物质的量大于NaOH的物质的量相等,酸剩余,故pH<7,故D正确;
故选D.
点评 本题考查酸碱混合时的定性判断及有关pH的计算,题目难度不大,注意判断酸碱的强弱并以此判断反应的过量问题.


科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、HCO3-、NO3- | B. | OH-、Cl-、Mg2+、K+ | ||
| C. | NH4+、Na+、CH3COO-、NO3- | D. | Na+、NO3-、Fe3+、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中能大量存在:Na+、K+、Cl-、NH4+ | |
| B. | 加入金属铝后溶液中有大量气泡产生的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、K+、Br- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+ Na+ OH-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、Cl-、OH- | B. | Fe2+、Mg2+、SO42-、Cl- | ||
| C. | K+、Na+、CO32-、OH- | D. | Na+、Ba2+、HCO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝元素是地壳中含量最多的元素 | |
| B. | 工业炼铝采用电解熔融的铝土矿的方法 | |
| C. | 冰晶石能使氧化铝熔融温度降低 | |
| D. | 工业上可用电解熔融氯化铝制取金属铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

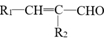 +H2O
+H2O +R2-OH$\stackrel{一定条件}{→}$
+R2-OH$\stackrel{一定条件}{→}$ +HCl
+HCl .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于稀盐酸中:CO32-+2H+═H2O+CO2↑ | |
| B. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铁与稀盐酸反应:2Fe+6H+═3H2↑+2Fe3+ | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com