
【题目】在一定温度下,可逆反应A(g)+3B(g)2C(g)达到平衡的标志是
A.A、B、C的浓度不再变化
B.A、B、C的物质的量之比为1:3:2
C.单位时间内生成1mol A的同时生成3mol B
D.2υ正(B)= 3υ逆(C)
【答案】AD
【解析】
可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量都不变,以及由此引起的一系列物理量不变,据此分析解答。
A.可逆反应达到平衡状态时,正逆反应速率相等,则反应体系中各物质浓度不变,所以当A、B、C的浓度不再变化时该反应达到平衡状态,故A正确;
B.当A、B、C的浓度之比为1:3:2时,该反应可能达到平衡状态也可能不达到平衡状态,与反应物初始浓度及转化率有关,所以不能据此判断平衡状态,故B错误;
C.无论反应是否达到平衡状态,都存在单位时间内生成1molA,同时生成3molB,所以不能据此判断平衡状态,故C错误;
D.2υ正(B)= 3υ逆(C),即![]() ,不同物质的正逆反应速率之比等于计量系数值比,能据此判断反应达到平衡状态,故D正确;
,不同物质的正逆反应速率之比等于计量系数值比,能据此判断反应达到平衡状态,故D正确;
答案选AD。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F有以下转化关系.A的产量是衡量一个国家石油化工生产水平的标志;D能使石蕊试液变红;E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子聚合物,常用于制食品袋.结合如图关系回答问题:
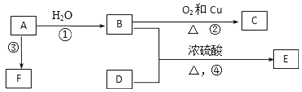
![]() 写出A的结构简式______;写出D中官能团的名称______.
写出A的结构简式______;写出D中官能团的名称______.
![]() 写出反应
写出反应![]() 的反应类型______.
的反应类型______.
![]() 写出反应
写出反应![]() 的反应方程式______.写出反应
的反应方程式______.写出反应![]() 的反应方程式______.
的反应方程式______.
![]() 的同分异构体有多种,写出其中与D互为同系物的任意一种物质的结构简式______.
的同分异构体有多种,写出其中与D互为同系物的任意一种物质的结构简式______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒中的新药。合成丁苯酞(J)的一种路线如图所示:
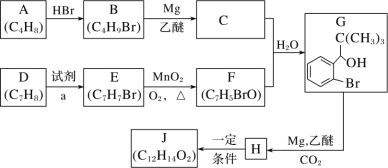
已知:
(1)B 的化学名称是_____,F 中含氧官能团名称是_____。
(2)由 E 生成 F 和 H 生成J 的反应类型分别是_____、_____。
(3)试剂 a 是_____。
(4)J 是一种环酯,则J 的结构简式为_____。H 在一定条件下还能生成高分子化合物 K,H 生成K 的化学方程式为:_____________________。
(5)M 的组成比 F 多 1 个 CH2 基团,M 的分子式为 C8H7BrO,M 的同分异构体①能发生银镜反应;②含有苯环;③不含甲基。满足上述条件的M 的同分异构体共有_____种。
(6)利用题中信息写出以乙醛和苯为原料,合成![]() 的流程图(其他试剂自选)。______________
的流程图(其他试剂自选)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的反应判断,下列说法中错误的是

A.该反应的△H大于0
B.CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量
C.化学键断裂吸收能量,化学键形成放出能量
D.由该反应可推知:凡是需要加热才能发生的反应均为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某纯碱样品含有少量![]() 杂质,某兴趣小组用如图所示装置测定纯碱样品中
杂质,某兴趣小组用如图所示装置测定纯碱样品中![]() 的质量分数(铁架台、铁夹等均已略去)。
的质量分数(铁架台、铁夹等均已略去)。
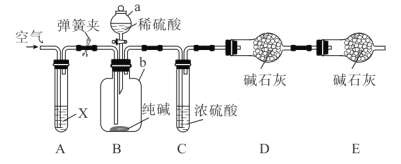
实验步骤如下:
Ⅰ.按图连接装置,并检查气密性;
Ⅱ.准确称量盛有碱石灰的干燥管![]() 的质量为
的质量为![]() ;
;
Ⅲ.准确称量![]() 纯碱样品放入容器
纯碱样品放入容器![]() 中;
中;
Ⅳ.打开分液漏斗![]() 的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
Ⅴ.打开弹簧夹,往试管![]() 中缓缓鼓入空气数分钟,最后称得干燥管
中缓缓鼓入空气数分钟,最后称得干燥管![]() 的质量为
的质量为![]() 。
。
请回答下列问题:
(1)检查装置![]() 气密性的方法为____________。
气密性的方法为____________。
(2)装置![]() 中试剂
中试剂![]() 应选择_____,目的是________。
应选择_____,目的是________。
(3)装置![]() 的作用是____,步骤
的作用是____,步骤![]() 中“缓缓鼓入空气数分钟”的目的是____________。
中“缓缓鼓入空气数分钟”的目的是____________。
(4)根据实验中测得的有关数据,计算纯碱样品![]() 的质量分数为___(保留三位有效数字),若没有装置
的质量分数为___(保留三位有效数字),若没有装置![]() ,会导致测量结果____(填“偏大”“偏小”或“无影响”)。
,会导致测量结果____(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4),也称为保险粉,Na2S2O4易溶于水,难溶于甲醇,具有极强的还原性,易被空气氧化,在碱性介质中稳定。工业上常用制备Na2S2O4的方法有I锌粉法、II甲酸钠法。
Ⅰ.实验室模拟锌粉法的装置如下(加热等辅助仪器略去)
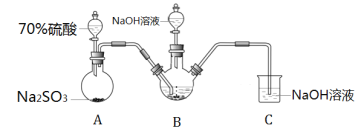
(1)第一步,将A中生成的气体通往B中进行反应,B中装的是颗粒度约为180m的锌粉与水形成的分散系,该分散系为___(填“溶液”、“胶体”或“悬浊液”)。在B装置生成连二亚硫酸锌的化学反应方程式为___。
(2)第二步,加入NaOH溶液,于28~35℃下反应生成Na2S2O4和一种白色沉淀,沉淀的成分为___(写化学式)。
(3)第三步,将第二步的混合物过滤,并向滤液中加入固体NaCl,冷却至20℃,便有Na2S2O4晶体析出;用平衡移动的原理解释加入NaCl固体的作用是___。
第四步,过滤,用甲醇洗涤滤渣,干燥,得到Na2S2O4晶体。
II.实验室模拟甲酸钠法的装置如下(加热等辅助仪器略去)

第一步,在F装置中加入甲酸钠浓溶液、氢氧化钠,甲醇(溶剂)的混合液;
第二步,向装置F中通入二氧化硫;
第三步,75℃加热一段时间,装置中有晶体析出,并产生大量气体;
第四步,过滤、洗涤、干燥,收集产品。
(4)装置F中制备连二亚硫酸钠的化学方程式可表示为___。
(5)已知某温度下,H2SO3的电离常数为K1≈1.5×10-2,K2≈1.0×10-7,H2CO3的电离常数为K1≈4.4×10-7,K2≈4.7×10-11。装置G用于吸收未反应完的SO2和反应产生的CO2。该温度下当G溶液中HSO3-、SO32-离子浓度相等时,溶液的pH约为___。
甲酸钠法于1968年实现工业化,继而逐渐替代了锌粉法生产连二亚硫酸钠。与锌粉法相比,甲酸钠法的优点在于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图六个操作是常见物质的分离提纯操作,则有关这的说法不正确的是

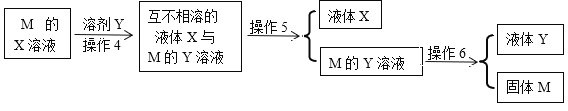
A. 操作1、操作2、操作6都可以是蒸馏,也可以是蒸发
B. 操作2可以是蒸发浓缩、冷却结晶、过滤
C. 操作3可以是洗剂、干燥
D. 操作4、操作5分别是萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )

A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
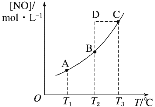
A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com