
化学平衡原理在工农业生产中发挥着重要的指导作用.
(1)反应C(s)+CO2(g)⇌2CO(g)平衡常数K的表达式为 = ;已知C(s)+H2O(g)⇌CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)⇌CO(g)+H2O(g)的平衡常数为K2,则K与K1、K2二者的关系为 .
(2)已知某温度下,反应2SO2(g)+O2 (g)⇌2SO3(g),的平衡常数K=19,在该温度下的体积固定的密闭容器中充入C(SO2)=1mol•L﹣1,C(O2)=1mol•L﹣1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行.
(3)对于可逆反应:aA(g)+bB(g)⇌cC(g)+dD(g)△H=a kJ•mol﹣1;若a+b>c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a 0(填“>”或“<”)
考点:
化学平衡常数的含义;化学平衡建立的过程;化学平衡的影响因素.
专题:
化学平衡专题.
分析:
(1)化学平衡常数,是指在一定温度下,达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
根据各反应的平衡常数,判断K与K1、K2的关系;
(2)根据三段式计算出SO2转化率为80%时,各组分的浓度,计算浓度商Qc,根据浓度商与平衡常数的关系,判断是否处于平衡状态或平衡的移动方向,Qc=k,处于平衡状态,Qc>k反应向逆反应进行,Qc<k反应向正反应进行;
(3)增大压强平衡向气体体积减小的方向移动;
升高温度,平衡向逆反应方向移动,说明正反应是放热反应.
解答:
解:(1)反应C(s)+CO2(g)⇌2CO(g)的平衡常数K=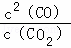 ;
;
反应C(s)+H2O(g)⇌CO(g)+H2(g)的平衡常数为K1=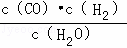 ,反应H2(g)+CO2(g)⇌CO(g)+H2O(g)的平衡常数为K2=
,反应H2(g)+CO2(g)⇌CO(g)+H2O(g)的平衡常数为K2=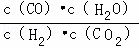 ,由平衡常数
,由平衡常数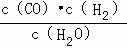 ×
×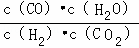 =
=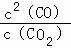 ,即K=K1×K2;
,即K=K1×K2;
故答案为: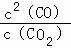 ;K=K1×K2;
;K=K1×K2;
(2)该温度下SO2转化率为80%时,△c(SO2)=1mol•L﹣1×80%=0.8mol/L,则:
2SO2(g)+O2 (g)⇌2SO3(g),
开始(mol/L):1 1 0
变化(mol/L):0.8 0.4 0.8
SO2转化率为80%时(mol/L):0.2 0.6 0.8
所以浓度商Qc=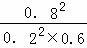 =26.7>19,该反应未达平衡状态,反应向逆反应进行;
=26.7>19,该反应未达平衡状态,反应向逆反应进行;
故答案为:否,逆反应;
(3)增大压强平衡向气体体积减小的方向移动,由于a+b>c+d,故平衡向正反应移动;
升高温度,平衡向逆反应方向移动,说明正反应是放热反应,即a<0;
故答案为:正反应,<.
点评:
考查化学平衡常数及计算、化学平衡影响因素等,难度中等,平衡常数的有关计算是高考的热点,注意化学平衡常数的书写,利用平衡常数可以判断反应进行的程度,判断反应的热效应,判断反应进行的方向,计算转化率等.


科目:高中化学 来源: 题型:
.适用相关化学知识进行判断,下列结论正确的是
A.某吸热反应能自发进行,则该反应的△S>0
B.SO2使酸性KMnO4溶液褪色,因此SO2具有漂白性
C.在物质分离的方法中,蒸馏、萃取、重结晶都与物质的溶解度有关
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能加快生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个体积为2L的容器中,充入4mol CO和4mol H2O,一段时间后反应CO(g)+H2O(g)⇌CO2(g)+H2(g)在密闭容器中达到了平衡状态.平衡后c[CO2]=1.8mol•L﹣1,则该温度下此反应的平衡常数K为( )
|
| A. | 27 | B. | 36 | C. | 54 | D. | 81 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于能量判据和熵判据的说法中,不正确的是( )
|
| A. | 放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程 |
|
| B. | 由能量判据和熵判据组合成的复合判据,将更适合于所有的过程 |
|
| C. | 在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行 |
|
| D. | 放热过程(△H<0)或熵增加(△S>0)的过程一定是自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是五种银盐的溶度积常数(25℃),下列有关说法错误的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积 | 1.8×10﹣10 | 1.4×10﹣5 | 6.3×10﹣50 | 7.7×10﹣13 | 8.51×10﹣16 |
|
| A. | 五种物质在常温下溶解度最大的是Ag2SO4 |
|
| B. | 将AgCl溶解于水后,向其中加入Na2S,则可以生成黑色的Ag2S沉淀 |
|
| C. | 沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动 |
|
| D. | 常温下,AgCl、AgBr和AgI三种物质的溶解度随着氯、溴、碘的顺序逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
类似于水的离子积,难溶盐AmBn也有离子积Ksp,且Ksp=[c(An+)]m•[c(Bm﹣)]n,已知常温下BaSO4的溶解度为2.33×10﹣4g,则其Ksp为( )
|
| A. | 2.33×10﹣4 | B. | 1×10﹣5 | C. | 1×10﹣10 | D. | 1×10﹣12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且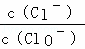 的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是()
的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是()
A. 改变温度,产物中KClO3的最大理论产量为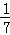 amol
amol
B. 若某温度下,反应后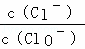 =11,则溶液中
=11,则溶液中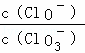 =
=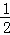
C. 参加反应的氯气的物质的量等于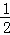 amol
amol
D. 改变温度,反应中转移电子的物质的量ne的范围: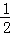 amol≤ne≤amol
amol≤ne≤amol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com