
| m |
| M |
| n |
| V |
| 4.9g |
| 58.5g/mol |
| 0.084mol |
| 0.5L |
| 25g |
| 180g/mol |
| 0.139mol |
| 0.5mol |


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、1molO的质量是32g |
| B、HCl相对分子质量36.5g/mol |
| C、SO42-的摩尔质量是96g/mol |
| D、Na的摩尔质量23 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、①④⑤ |
| C、③④ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
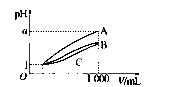 pH=1的三种酸溶液A、B、C各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的三种酸溶液A、B、C各1mL,分别加水稀释到1000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A、溶液的物质的量浓度C>B>A |
| B、酸性A>B>C |
| C、若a=4,则A是强酸,B、C是弱酸 |
| D、若1<a<4,则A、B、C都是弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 4 3 2 2 6 |
| B、0 2 1 0 1 2 |
| C、2 0 1 2 0 2 |
| D、2 10 6 2 5 12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、③④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试样 | 所加试剂 | 实验现象及测定数值 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 溶液呈蓝色 |
| 第二份试液 | 滴加过量的盐酸酸化的BaCl2溶液 | 白色沉淀0.932g |
| 第三份试液 | 滴加0.01mol/LNaOH溶液体积V,与生成沉淀的关系,如右图 | 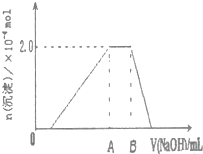 |
| 第四份试液 | 滴加过量的AgNO3 | 白色沉淀1.535g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com