
【题目】某学习小组设计以下的实验方案,测定镁铝合金中铝的质量分数。
方案一:将m1g镁铝合金中溶解在足量的试剂X中,充分反应后,过滤、洗涤、干燥、称量,得到质量为m2 g的固体。
(1)试剂X是_____,反应的离子方程式是____;
(2)如果在实验的过程中,没有对固体进行洗涤,则测得铝的质量分数将_____(填“偏大”“偏小”或“无影响”)。
方案二:选择如图所示的装置和药品。

(3)组装完仪器以后,需要进行的实验操作是_____;
(4)导管a的作用是______;
(5)读数时需要注意的事项有_____;
(6)如果合金的质量是a g,测得气体的体积为b L(已换算为标准状况时的体积),则合金中铝的质量分数是_____。
【答案】NaOH 2Al + 2OH-+ 2H2O =2AlO2-+ 3H2↑ 偏小 检查装置的气密性 平衡气压,使液体顺利流下 冷却至室温,液面相平 ![]()
【解析】
根据铝和氢氧化钠反应而镁不和氢氧化钠反应进行设计实验进行分离,也可以利用二者都和酸反应测定氢气的体积从而计算。
(1)根据只有铝能溶于氢氧化钠NaOH,而镁不能和氢氧化钠反应,将合金溶于氢氧化钠溶液中,最后得到的固体为金属镁。反应的离子方程式为:2Al + 2OH-+ 2H2O =2AlO2-+ 3H2↑;
(2)如果固体没有洗涤,会造成金属镁的质量增加,则铝的质量分数偏小;
(3).因为实验中要测定气体的体积,所以组装完应检查装置的气密性;
(4).锥形瓶中反应生成气体,压强变化,用导管a连接锥形瓶和分液漏斗,能平衡气压,使液体顺利流下;
(5)读数应注意测定室温常压情况下的气体体积,所以需要冷却至室温,液面相平,使两侧的气体的压强相同;
(6).根据方程式分析,Mg-H2 , 2Al-3H2 假设镁的物质的量为xmol,铝的物质的量为ymol,则有24x+27y=a,x+1.5y=b/22.4 ,y=![]() ,则铝的质量分数为
,则铝的质量分数为![]() 。
。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为______________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为____,C原子的杂化形式为______。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中甲、乙、丙表示某动物细胞中的不同化合物,下列叙述正确的是( )

A. 核糖核苷酸是构成物质甲的基本单位
B. 物质甲为该生物的主要遗传物质
C. 物质丙是构成细胞的基本骨架
D. 物质乙的种类和数量与细胞膜的功能密切相关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组在实验室模拟工业上从浓缩海水中提取溴的工艺流程,设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。下列说法错误的是
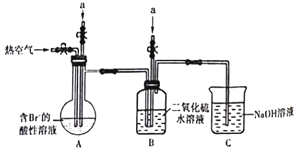
A.装置中通入的是a气体是Cl2
B.实验时应在A装置中通入a气体一段时间后,停止通入,改通入热空气
C.B装置中通入a气体前发生的反应为SO2+ Br2+2H2O===H2SO4+2HBr
D.C装置的作用只是吸收多余的二氧化硫气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在______ molAl2(SO4)3中含0.3molSO42- ,含Al3+约_______________个。
(2)标况下,11.2LNH3的质量为:____________g。
(3)20g某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是_________。
(4)在100mLFe2(SO4)3溶液中含Fe3+11.2 g,则溶液中Fe3+浓度____________,取该溶液25ml加水稀释至300mL,则此时稀溶液中SO42﹣的物质的量浓度为____________。
(5)在标况下,22.4L由氮气和氧气组成的混合气体,其质量为30g,则氧气的质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质(AgNO2是淡黄色难溶于水的固体)
实验 | 装置 | 试剂a | 现象 |
① |
| 酚酞 | 无色溶液变红 |
② | AgNO3溶液 | 产生淡黄色沉淀 | |
③ | 淀粉KI 溶液+稀硫酸 | 无色溶液立即变蓝 | |
④ | 酸性K2Cr2O7溶液 | 无色溶液变为绿色 |
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2-+H2OHNO2+OH-
B.NaNO2可与某些盐发生复分解反应:NO2-+Ag+=AgNO2↓
C.NaNO2有氧化性:2I-+2H++2NO2-=I2+2NO2↑+H2O
D.NaNO2有还原性:Cr2O72-+3NO2-+8H+=3NO3-+2Cr3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
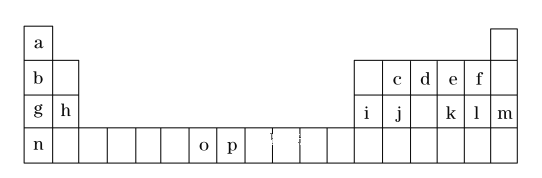
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
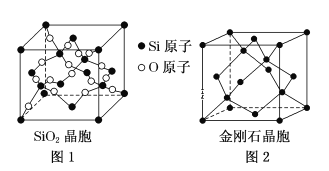
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从矿物学资料查得,一定条件下FeS2(二硫化亚铁)存在反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2参加反应,有10 mol电子转移
C.FeS2只作还原剂
D.产物中的![]() 有一部分是氧化产物
有一部分是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:

请回答下列问题:
(1)实验室只有100mL、250mL、500mL三种规格的容量瓶,但要配制480 mL 0.50 mol/L的稀硫酸,需量取该浓硫酸______mL。
(2)接下来完成此实验你将用到的仪器有20mL量筒、烧杯、玻璃棒、胶头滴管、____________。
(3)使用容量瓶前必须进行的一步操作是____________。
(4)要从所配溶液中取出10 mL稀释至20 mL,则稀释后溶液的物质的量浓度为__________。
(5)下列操作会使所配溶液浓度偏低的是__________。
A. 用量筒量取浓硫酸,读数时仰视刻度线
B. 转移溶液时未洗涤烧杯
C. 定容时俯视容量瓶的刻度线
D. 定容摇匀后,发现液面低于刻度线,再加水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com