
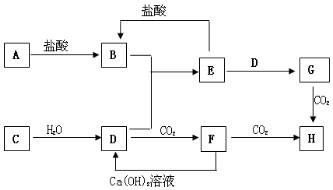
 如图,图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去)
如图,图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、H的焰色反应均呈黄色,在通常状况下E(氢氧化物)跟NaOH或盐酸均可发生复分解反应.(反应过程中生成的水及其他产物已略去) ;F是Na2CO3.(填化学式)
;F是Na2CO3.(填化学式) .
.分析 H的焰色反应呈黄色,说明H中有钠元素,C均为金属单质,C与水反应生成D,D与二氧化碳生成F,F再与二氧化碳反应生成H,且F与氢氧化钙生成D,可推知,C为Na,D为NaOH,F为Na2CO3,H为NaHCO3,在通常状况下E跟NaOH或盐酸均可以发生反应,E应为两性物质,根据G与二氧化碳生成H,且B和D可生成E,可推知E为Al(OH)3,G为NaAlO2,B为AlCl3 ,单质A为Al,以此解答该题.
解答 解:(1)由以上分析可知A为Al,原子结构示意图为 ,F为Na2CO3,故答案为:
,F为Na2CO3,故答案为: ;Na2CO3;
;Na2CO3;
(2)反应C→D是钠与水反应生成氢氧化钠与氢气,标出电子转移的方向和数目: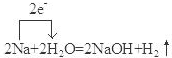 ,
,
故答案为: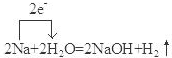 ;
;
(3)E转化为G的离子方程式:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评 本题考查无机物的推断,为高频考点,利用H、E性质结合各物质转化关系进行推断为解答本题的关键,题目难度中等,答题时注意元素化合物知识的灵活运用.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:2016-2017学年河北省唐山市高二上10月月考化学试卷 (解析版) 题型:填空题
2007年10月24日我国在西昌卫星发射中心用长征三号甲运载火箭将“嫦娥一号”卫星成功送入太空。“嫦娥一号”是我国自主研制的第一颗月球探测卫星,它的发射成功,标志着我国实施绕月探测工程迈出重要一步。
(1)火箭升空时,由于大气层的剧烈摩擦,产生高温,为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是( )
A.在高温下不熔化 B.在高温下可分解气化
C.在常温下就分解为气体 D.该涂料不可能发生分解
(2)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH=+8.7 kJ·mol-1,
N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH=-534.0 kJ·mol-1,
则肼跟N2O4反应的热化学方程式为_______________。
(3)已知H2O(l)=H2O(g),△H=+44kJ/mol-1。则16g液态肼与足量的N2O4反应生成氮气和液态水时放出的热量是_______________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W |
| A. | Y元素的气态氢化物易液化,是因为其分子间能形成氢键 | |
| B. | X元素最高价氧化物分子的比例模型为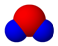 | |
| C. | Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 | |
| D. | W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cs显+3价,I、Cl均显-1价 | |
| B. | 在CsICl2溶液中通入SO2气体,有硫酸生成 | |
| C. | Cs显+1价,Cl显+1价,I显-3价 | |
| D. | 在CsICl2溶液中通入Cl2,有单质碘生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属单质在反应中只作还原剂 | |
| B. | 非金属单质在反应中只作氧化剂 | |
| C. | 金属失电子越多,其还原性越强有力 | |
| D. | Cu2+比Fe2+氧化性强,Fe比Cu还原性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2摩尔质量是60 | |
| B. | 1 molSiO2中含有1 molO2 | |
| C. | 1.5 molSiO2中含有1.806×1024个氧原子 | |
| D. | 1 molSiO2质量是60 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3+HCl═NaCl+H2O+CO2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$ 2KCl+2O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | 2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com