
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 黄绿色的氯水光照后颜色变浅 | |
| C. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| D. | 在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
分析 平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释.
解答 解:A.增大压强,平衡向正反应方向移动,能用平衡移动原理解释,故A不选;
B.氯气溶于水的反应是一个可逆反应,Cl2+H2O?HClO-+H++Cl-,光照条件下次氯酸分解生成HCl和氧气,导致平衡正向移动,所以黄绿色的氯水光照后颜色变浅,可以用平衡移动原理解释,故B不选;
C.该反应前后气体物质的量之和不变,增大压强平衡不移动,因为体积减小导致碘浓度增大而使颜色加深,所以不能用平衡移动原理解释,故C选;
D.溶液中存在平衡Fe3++SCN-?Fe(SCN)2+,加铁粉,铁与Fe3+反应,Fe3+浓度降低,则平衡向左移动进行,溶液颜色变浅或褪去,能用勒夏特利原理来解释,故D不选;
故选C.
点评 本题考查化学平衡移动原理,为高频考点,侧重考查学生对化学平衡移动原理概念的理解及运用,明确化学平衡移动原理适用范围是解本题关键,注意:催化剂只能改变反应速率不改变平衡移动,题目难度不大,易错选项是C.


科目:高中化学 来源: 题型:选择题
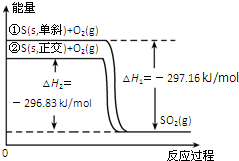
| A. | 单斜硫转化为正交硫的反应是吸热反应 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | ①表示断裂1mol O2中的共价键所吸收的能量比形成lmolSO2中的共价键所放出的能量少297.16 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16mol | B. | 6mol | C. | 12mol | D. | 4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
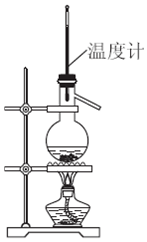
| A. | 制取乙烯 | |
| B. | 制取氯气 | |
| C. | 分离乙醇和水 | |
| D. | 分离水和碘的四氯化碳(常压下沸点76.8℃)溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
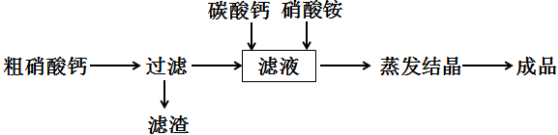

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com