
(15分)W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,已知W的一种同位素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻,N的单质是日常生活中常用的金属材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最强。
(1)W的另一种同位素的质子数与中子数相等,原子符号表示为 ;元素Y在周期表中的位置是 。
(2)下列有关物质性质的比较中,正确的是 (填字母编号)。
| A.W、X、Y三种元素最简单氢化物的稳定性:W>Y>X |
| B.M、X、Z三种元素形成的单质熔点:X>M>Z |
| C.Y、Z两种元素的含氧酸酸性:Z>Y |
| D.Y、Z两种元素的单核阴离子还原性:Y>Z |
(1)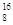 O;第三正周期第ⅥA族 (2)ABD (3)
O;第三正周期第ⅥA族 (2)ABD (3)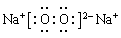 (4)正四面体
(4)正四面体
(5)HF (6)Al3++3AlO2-+6H2O=4Al(OH)3↓
解析试题分析:W、M、N、X、Y、Z是六种常见的短周期元素,其原子半径随原子序数的变化如右图所示,N的单质是日常生活中常用的金属材料,因此N是铝;N与X相邻,X的原子半径小于N,原子序数大于N,因此X只能是硅;Y的最外层电子数是其最内层电子数的3倍,所以Y是O或S,由于Y的原子序数大于X,所以Y是S;根据已知W的一种同位素的质量数为18,中子数为10,则质子数是8,故W是O;M和Ne原子的核外电子数相差1,且M的原子序数大于O小于于Al,原子半径最大,所以M是Na;Z的非金属性在同周期主族元素中最强,且原子序数最大,因此Z是Cl,则
(1)氧元素的另一种同位素的质子数与中子数相等,则质量数=8+8=16,所以原子符号表示为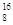 O;元素S的原子序数是16,在周期表中的位置是第三正周期第ⅥA族。
O;元素S的原子序数是16,在周期表中的位置是第三正周期第ⅥA族。
(2)A、O、Si、S三种元素非金属性强弱顺序为O>S>Si,非金属性越强,氢化物的稳定性越强,所以最简单氢化物的稳定性O>S>Si,A正确;B、Na、Si、Cl2三种单质形成的晶体类型分别为金属晶体、原子晶体和分子晶体,因此熔点:X>M>Z,B正确;C、Y、Z两种元素的最高价含氧酸酸性:Z>Y,C不正确;D、非金属性越强,相应阴离子的还原性越弱,氯元素的非金属性强于硫元素,则Y、Z两种元素的单核阴离子还原性:Y>Z,D正确,答案选ABD。
(3)元素W与M按原子个数比1:l形成的化合物是过氧化钠,电子式为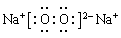 。
。
(4)元素X与Z形成的五原子分子是四氯化硅,其空间结构属于正四面体形。
(5)与Z同族的元素都能与氢元素形成氢化物,其中水溶液酸性最弱的是HF。
(6)含有N元素的两种离子在溶液中相遇能快速发生反应,该反应的离子方程式Al3++3AlO2-+6H2O=4Al(OH)3↓。
考点:考查元素周期表的结构以及元素周期律的应用等


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强。
(1)Y在周期表中的位置是 。
(2)用电子式解释X与W能形成化合物X3W的原因 。
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是 。
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是 。
(5)已知W的单质与气体B在一定条件下可形成气体A,即: W2 (g)+3B (g)  2A(g) △H =-92.4 kJ?mol―1
2A(g) △H =-92.4 kJ?mol―1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲、乙、丙、丁是四种短周期元素,乙原子中K层与M层电子数相等;甲原子的核外电子数比乙原子核外电子数少1;丙原子的最外层电子数是次外层电子数的2倍;丁原子核电荷数比丙原子核电荷数多2。请回答:
(1)甲的单质与水反应的离子方程式为 ;
(2)乙元素在周期表中的位置为 ;
(3)丙元素的最高价氧化物的电子式为 ;
(4)甲与丁两种元素可组成的具有强氧化性的物质是 。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(13分)近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
(3)Mn和Fe的部分电离能数据如表:
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |


查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分) A、B、C、D、E、F、G七种元素,试按下列所给条件推断,①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气态④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族,C的原子结构示意图是
(2)A元素与D元素形成化合物的电子式是
(3)F的元素符号是
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个 键:
键:
HNO2的酸性比HN03弱是因为_____
(4)亚硝基钻钠 是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的
是钴的一种配合物,易溶于水,与钾离子反应生成淡黄色的 沉淀,可用于检验K+的存在。
沉淀,可用于检验K+的存在。
①基态 的价层电子排布图为_____
的价层电子排布图为_____
②用亚硝酸钻钠检验K+的离子方程式是
③金属钴的堆积方式如图所示,若一个钴原子的半径为r,,则晶胞的体积V(晶胞)=__
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
由下列元素在周期表中的位置,写出元素原子的价电子排布式。
(1)第4周期ⅥB族;
(2)第5周期ⅠB族;
(3)第5周期ⅣA族;
(4)第6周期ⅡA族;
(5)第4周期ⅦA族。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com