
【题目】某工厂的废金属屑的主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
Ⅱ.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
Ⅲ.向Ⅱ所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
Ⅳ.……
(1)步骤I 中发生反应的化学方程式为___________、___________ 。
(2)步骤Ⅱ所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其可能的原因: ___________ 。
(3)步骤Ⅲ获得CuSO4 溶液的离子方程式为___________ 。
(4)步骤II 所得滤液经进一步处理可制得Na2FeO4,流程如下:
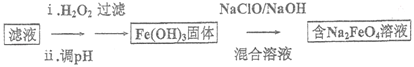
①测得滤液中c(Fe2+)为a mol/L,若要处理1m3滤液,理论上需要消耗25%的H2O2溶液___________kg(用含a 的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式: ___________ 。
【答案】 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Al2O3+2NaOH=2NaAlO2+H2O Fe+2Fe3+=3Fe2+ (2Fe3++Cu=2Fe2++CuFe+Fe2O3+6H+=3Fe2++3H2O) 2Cu+O2+4H+=2Cu2++2H2O 68a 2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
【解析】(1)废金属屑中能和氢氧化钠溶液反应的物质是金属铝和两性氧化物氧化铝,所以反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al2O3+2NaOH=2NaAlO2+H2O;(2)I所得固体中含有铁、铜和氧化铁,加入过量稀H2SO4后铁、氧化铁被溶解分别生成硫酸亚铁和硫酸铁。由于铁离子具有氧化性,能氧化单质铜生成铜离子和亚铜离子,所以加入KSCN溶液后不显红色,反应的离子方程式为Fe+2Fe3+=3Fe2+或((2Fe3++Cu=2Fe2++Cu、Fe+Fe2O3+6H+=3Fe2++3H2O));(3)铜与稀硫酸不反应,但在加热的条件下能被空气中的氧气氧化生成氧化铜,氧化铜可以溶解在稀硫酸中生成硫酸铜,反应的化学方程式为2Cu+O2+4H+=2Cu2++2H2O;
(4)①滤液中亚铁离子的物质的量是1000amol,生成氢氧化铁失去1000amol电子。双氧水在反应中氧元素的化合价从-1价降低到-2价,得到1个电子,因此1mol双氧水在反应中得到2mol电子。设需要双氧水溶液的质量是m,则根据电子得失守恒可知, ![]() ×2=1000amol,解得m=68000ag=68akg;②铁元素的化合价从+3价升高到+6价失去3个电子,次氯酸钠中氯元素的化合价从+1价降低到-1 价,得到2个电子。因此根据电子得失守恒可知还原剂与氧化剂的物质的量之比=2:3。根据原子守恒可知,反应中还有水生成,所以反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。
×2=1000amol,解得m=68000ag=68akg;②铁元素的化合价从+3价升高到+6价失去3个电子,次氯酸钠中氯元素的化合价从+1价降低到-1 价,得到2个电子。因此根据电子得失守恒可知还原剂与氧化剂的物质的量之比=2:3。根据原子守恒可知,反应中还有水生成,所以反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。


科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于少量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O
B.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-![]() 3Fe3++NO↑+3H2O
3Fe3++NO↑+3H2O
C.FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2===2Fe3++4Cl-+Br2
D.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO![]() ===BaSO4↓+H2O
===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A 是一种重要的光化学试剂,属不含结晶水的盐.A~I 之间相互转化关系如下图所示: (部分反应物、生成物没有列出)

已知: A 中含两种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且相对分子质量是C 的2倍。C、D 都为气体且含有元素种类相同,C 能使澄清石灰水变浑浊,E 是一种红棕色的颜料,F 的焰色反应呈紫色,I能使KSCN 溶液显红色。回答下列问题:
(1)A 的化学式________。
(2)①方程式________。
(3)D+E→C+G 的方程式________。
(4) H+H2O2+ H+→I 的离子反应方程式________。
(5)在A 的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去;而在A 的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究性学习小组对某硫酸亚铁晶体(FeSO4xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4xH2O中的x= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
A. 简单离子半径大小顺序: rX>rZ>rY
B. 元素W的氧化物对应水化物的酸性比Y的强
C. X与Y形成的原子晶体X3Y4的熔点比金刚石高
D. X与W形成的化合物和Z与W形成的化合物的化学键类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com