
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol/L的NaOH溶液中Na+的物质的量为1 mol
B.28g乙烯所含共用电子对数目为4NA
C.常温常压下,32g O2与O3的混合气体中含有的原子总数为2NA
D.1mol 苯中含有碳碳双键的数目为3 NA
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
对充有氖气的霓虹灯管通电,灯管发出红色光。产生这一现象的主要原因( )
A.电子由激发态向基态跃迁时以光的形式释放能量
B.电子由基态向激发态跃迁时吸收除红光以外的光线
C.氖原子获得电子后转变成发出红光的物质
D.在电流的作用下,氖原子与构成灯管的物质发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关晶体的叙述中,错误的是( )
A.在SiO2晶体中,每个Si原子与4个O原子形成共价键
B.在面心立方密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子
C.NaCl晶体中与每个Na+距离相等且最近的Cl—有6个;
D.CsCl晶体中与每个Cs+距离相等且最近的Cl—有8个
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的能量最高的电子层的符号为 ,该电子层具有的原子轨道数为 。
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞平均拥有8个硅原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,同时产生一种可使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中, 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si与O的原子数之比为 化学式为 。
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si与O的原子数之比为 化学式为 。
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中d极产生具有氧化性的气体在标准状况下为2.24L。下列说法正确的是
A.A池为电解池,B池为原电池
B.两池中d、e两极都发生氧化反应
C.B池中e极应为粗铜板材料
D.B池中e极质量增加12.8g
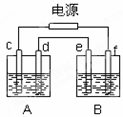
查看答案和解析>>
科目:高中化学 来源: 题型:
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是


A.液滴中的Cl-由a区向b区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- = 4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e- = Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
离子方程式:CO32- + 2H+ = CO2↑ + H2O表示( )
A.碳酸盐和盐酸盐之间的反应
B.一切碳酸盐与一切酸之间的反应
C.可溶性碳酸盐与酸之间的反应
D.可溶性碳酸盐与强酸之间的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是周期表中的一部分,根据A—N在周期表中的位置,按要求回答下列问题:
|
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | M | N |
(1)表中元素,只有负价而无正价的元素是 ,氧化性最强的单质是 ,还原性最强的单质是 ;(用相关的元素符号或分子式表示)
(2)最高价氧化物的水化物碱性最强的是 ___,酸性最强的是 __________,呈两性的是 ;(本小题均填物质的名称)
(3)A、B、C、D、F、H、I形成的单质中,熔点最高的物质的化学式为 ;
(4)在B、C、D、F、G、H中,原子半径从大到小的顺序为的是 __________________.(用元素符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com