
| A. | 根据lmolO2和Mg完全反应获得4mol电子;可推出lmo1 O2和其他金属完全反应都获得4mol电子 | |
| B. | 相同pH值的H3PO4和H2SO4溶液,稀释相同倍数再分别测其pH值,若H3PO4溶液的pH小于H2SO4溶液,可推出元素的非金属性S>P | |
| C. | 根据Cl2+2KI=2KCl+I2反应中,氧化性:Cl2>I2;可推出SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,氧化性:C>Si | |
| D. | 向3%H2O2溶液中加0.1gMnO2粉末比加2滴1mol•L-1FeCl3溶液反应剧烈;根据此实验可推出MnO2的催化效果一定比FeCl3好 |
分析 A.lmo1O2和金属反应时,如果生成的化合物中O元素显-2价,则氧气得到4mol电子,如果生成的化合物中O元素显-1价,则氧气得到2mol电子;
B.加水稀释促进弱酸的电离,根据稀释pH值变化可判断硫酸为强酸,磷酸为弱酸,最高价含氧酸的酸性越弱,则元素的非金属性越弱;
C.氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
D.比较催化效果应在同一条件下进行比较.
解答 解:A.lmo1O2和金属反应时,如果生成的化合物中O元素显-2价,则氧气得到4mol电子,如果生成的化合物中O元素显-1价,则氧气得到2mol电子,如生成Na2O2,故A错误;B.将等PH的H3PO4和H2SO4溶液稀释相同的倍数,再分别测其pH值,磷酸溶液的PH变化小,因加水稀释促进磷酸的电离,所以磷酸为弱酸,最高价含氧酸的酸性越弱,则元素的非金属性越弱,因此可推出元素的非金属性S>P,故B正确;
C.Cl2+2KI=2KCl+I2反应中,Cl2为氧化剂,I2为氧化产物,所以氧化性:Cl2>I2,SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑反应中,氧化剂为SiO2,CO为氧化产物,所以氧化性:SiO2>CO,故C错误;
D.比较MnO2与FeCl3的催化效果需在同一条件下进行比较,因二氧化锰为固体,氯化铁为溶液,所以该实验比较催化效果错误,应选择都为固体且都为粉末状,且加入的质量相同,然后再进行比较,故D错误;
故选B.
点评 本题考查探究化学规律,为高频考点,涉及氧化还原反应、非金属性比较、催化剂催化效果等,把握物质的性质、反应原理为解答的关键,侧重分析能力的考查,题目难度中等.


科目:高中化学 来源: 题型:推断题
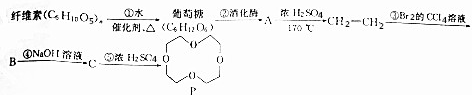
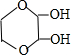 、
、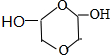 (任写一种)(不考虑立体异构)
(任写一种)(不考虑立体异构)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
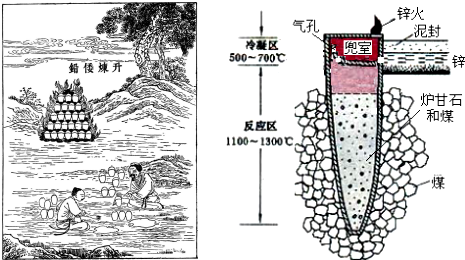
| A. | 升炼倭铅过程包含分解反应和氧化还原反应 | |
| B. | 冶炼时锌变为蒸气在兜室冷凝为固体 | |
| C. | “泥封”的目的是为了防止得到的锌被氧化 | |
| D. | “锌火”是锌蒸气和一氧化碳在空气的燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
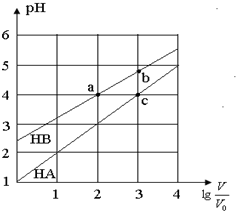 常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )
常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列叙述正确的是( )| A. | 该温度下HB的电离平衡常数a<b | |
| B. | 溶液中水的电离程度:a=c>b | |
| C. | 相同条件下NaA溶液的pH小于NaB溶液的pH | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若同时微热两种溶液(不考虑HA、HB和H2O的挥发),则$\frac{c({B}^{-})}{c({A}^{-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池在充电过程中,正、负极质量都增大 | |
| B. | 反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| C. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)}{c(N{{H}_{4}}^{+})}$的值减小 | |
| D. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
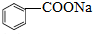 ,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)( )| A. | 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 | |
| B. | 提高CO2充气压力,饮料中c(A-)不变 | |
| C. | 当pH为5.0时,饮料中$\frac{c(HA)}{c({A}^{-})}$=0.16 | |
| D. | 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH-)-c(HA) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com