
【题目】在淀粉溶液中加入淀粉酶,一段时间后取出部分水溶液滴加碘水,不变蓝色,则证明水溶液中不含有 ( )
A. 淀粉 B. 葡萄糖 C. 高分子 D. 麦芽糖
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,2.24L三氯甲烷中所含分子数为NA
B. 1molH2与1molI2(g)于密闭容器中反应,生成的H-I键数为2NA
C. 常温下,0.1molFe投入到足量浓硫酸中反应,转移的电子数为0.3NA
D. 8.8g乙酸乙酯和乙醛(CH3CHO)的混合物中含有的C原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应X2(g)+H2(g)![]() 2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
2HX(g)的平衡常数为100。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A. 5% B. 17% C. 25% D. 33%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有下列 11 种物质:
①纯碱 ②Mn2O7 ③硫酸 ④CaO ⑤CO2 ⑥Na2CO3
⑦CuSO4·5H2O ⑧SO2 ⑨Na2O2 ⑩CO NO2
其中属于正盐的是______________;属于酸性氧化物的是__________________。
(2)有关胶体的实验中:
①实验室制备Fe(OH)3胶体的化学方程式为_________
②将橘红色的硫化锑(Sb2S3)胶体,装入U形管,插入电极后通直流电,发现阳极负极橘红色加深,证明Sb2S3胶粒带______(填“正”或“负”)电荷。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某混合溶液中只含有下列几种离子(不考虑水的电离):Na+、Mg2+、Al3+、Cl-、SO42-,若Na+、Mg2+、Cl-、SO42-的物质的量浓度依次为 0.2 mol/L、0.25 mol/L、0.5 mol/L、0.25mol/L,则 c(Al3+)=________ 。
(2) 某物质 A 加热时按化学方程式 2A═2B+C+3D 分解,产物均为气体,测得由生成物组成的混 合物气体对 H2 的相对密度为 20,则反应物 A 的摩尔质量为_____ 。
(3)在标准状况下,将 VL A 气体(摩尔质量为 Mg/mol)溶于 0.1L 水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为_________mol·L-1
A.1000Vρ/(MV+22400)mol·L-1 B.Vρ/(MV+22400)mol·L-1
C.100VρM/(MV+22400)mol·L-1 D.MV/22.4(V+0.1) ρmol·L-1
(4)生态农业涉及农家肥料的综合利用.某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气 的混合气体 8.96L(标准状况).该气体通过盛有红色 CuO 粉末的硬质玻璃管,发生的反应为:CH4+4CuO![]() CO2↑+2H2O↑+4Cu,.当甲烷完全反应后,硬质玻璃管的质量减轻了 4.8g。将反应后气体通入 2L 0.1mol/L 的澄清 Ca(OH)2 溶液,充分吸收,生成沉淀 10g.求:
CO2↑+2H2O↑+4Cu,.当甲烷完全反应后,硬质玻璃管的质量减轻了 4.8g。将反应后气体通入 2L 0.1mol/L 的澄清 Ca(OH)2 溶液,充分吸收,生成沉淀 10g.求:
①原混合气体中甲烷的体积(标准状况)___________________________________________________
②反应后的气体中 CO2 的物质的量为_______________________
(5)为确定铬钾矾 xK2SO4·yCr2(SO4)3·zH2O的分子式,配成含此物质 31.28g 的溶 液 400mL,取 200mL 的溶液加入 1mol/L 的Ba(NO3)2溶液 100mL,生成沉淀,过滤后滤液中 加入 0.1mol/L H2SO4 溶液,消耗 200mL 硫酸时沉淀恰好完全,用过量氨水处理剩余的 200mL 溶液,生成 Cr(OH)3 沉淀 4.12g,试确定 x、y、z 的值.____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素中有N、P、As三种非金属元素,请回答下列相关问题。
(1)基态砷原子的价电子排布式为_________________,同周期元素原子中与其含有相同数目未成对电子的是___________________(填元素符号)。
(2)雄黄(As4S4)是很多人熟悉的一种物质,其分子结构如图所示,分子中所有原子最外层均达到8电子结构。分子中含有的σ键的数目是__________________,●表示的原子是______________,该原子的杂化形式是____________________。
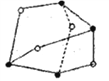
(3)硝酸的沸点较低,从氢键的角度推断其可能的原因是_______________________。硝酸根的空间构型是_____________________。
(4)白磷(P4)晶体中分子堆积方式属于分子密堆积,每个分子周围紧邻的分子有_________个。若白磷晶体晶胞的棱长为ypm,阿伏伽德罗常数的数值用NA表示,则白磷晶体的密度为____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,离子不存在。图为H3PO4(图中用H3A表示)在加入强酸或强碱溶液后,平衡时溶液中各微粒浓度的对数值(lgc)-pH图。下列说法不正确的是( )
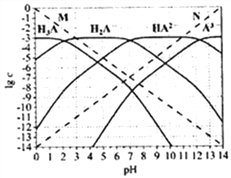
A. H3PO4、H2PO4-、HPO42-、PO43-不能在同一溶液中大量共存
B. H3PO4电离平衡常数Ka2≈1×10-7
C. 图中虚线M、N分别代表H+和OH-
D. pH=10时,溶液中存在关系:c(HPO42-)>c(OH-)>c(PO43-)>c(H2PO4-)>c(H3PO4)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 NA
C. 标准状况下,22.4 L H2O的分子数为1NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com