短周期元素X、Y、Z可组成化合物Y2X和ZX2.Y2X溶于水形成的溶液能与ZX2反应生成一种化合物Y2ZX3.已知三种元素原子的质子总数为25,且Y是短周期中原子半径最大的元素,Z原子的最外层电子数是次外层电子数的2倍.试回答:
(1)X、Y元素的名称:X______; Y______.
(2)元素X的一种核素有10个中子,该核素可表示为______.
(3)Y2X对应水化物的电子式______,ZX2的电子式为______.
(4)写出Y2X溶于水的溶液与ZX2反应生成化合物Y2ZX3的离子方程式______.
(5)一定量的Y2X2与ZX2反应后得到固体物质A,A恰好与含0.8molHCl的稀盐酸完全反应并收集到0.25mol气体,则用______物质的量表示A的组成为:______.
【答案】
分析:同周期元素原子半径从左至右依次增大,同主族元素原子半径从上到下依次增大,由此规律推出Y;最外层电子数是次外层电子n(n>1)倍的元素,一定在第二周期,可以推出Z,,再据质子总数推出X
解答:解:(1)Y是短周期中原子半径最大的元素,则Y为Na;Z原子的最外层电子数是次外层电子数的2倍,则Z为C,三种元素原子的质子总数为25,则X为O.故答案为:氧 钠;
(2)X的质子数为8,含有10个中子的核素质量数为18,该核素可表示为

,故答案为:
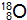
;
(3)氧化钠的水化物是氢氧化钠,属于离子化合物,写电子式时,阴离子用中括号括起来,二氧化碳是共价化合物,碳原子形成4个共价键,Y
2X对应水化物的电子式为
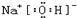
,ZX
2的电子式为为

,
故答案为:


;
(4)二氧化碳与氢氧化钠溶液反应生产碳酸钠和水,反应的方程式为2OH
-+CO
2=CO
32-+H
2O,
故答案为:2OH
-+CO
2=CO
32-+H
2O;
(5)过氧化钠与二氧化碳反应生成的A中含碳酸钠,还可能含有没有反应的过氧化钠,设A中含碳酸钠的物质的量是x,过氧化钠物质的量是y,据气体物质的量得:

y+x=0.25 ①
据钠、氯守恒得:2x+2y=0.8 ②,联立①②解得x=0.1 y=0.3,故答案为:0.3molNa
2O
2,0.1molNa
2CO
3点评:本题主要考查元素推断及物质的性质,要熟练应用元素周期律及原子核外电子排布规律、有关物质的性质.

 ,故答案为:
,故答案为: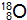 ;
;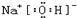 ,ZX2的电子式为为
,ZX2的电子式为为 ,
,
 ;
; y+x=0.25 ①
y+x=0.25 ①
