
| A、硬度比生铁低 |
| B、在潮湿的空气中放置不易生锈 |
| C、在冷的浓硫酸中钝化 |
| D、不能与盐酸反应 |
科目:高中化学 来源: 题型:
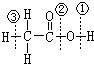 ,下列关于反应与断键部位叙述正确的是( )
,下列关于反应与断键部位叙述正确的是( )| 红磷 |
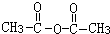 +H2O,是①②键断裂.
+H2O,是①②键断裂.| A、(1)(2)(3) |
| B、(2)(3)(4) |
| C、(1)(3)(4) |
| D、(1)(2)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHS溶于水:NaHS═Na++HS-,HS-+H2O?H3O++S2- | ||||||
B、Al(OH)3电离:H2O+AlO
| ||||||
C、(NH4)2SO4溶于水:(NH4)2SO4?2NH
| ||||||
| D、HF溶于水:HF+H2O?H3O++F- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
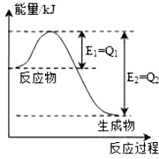
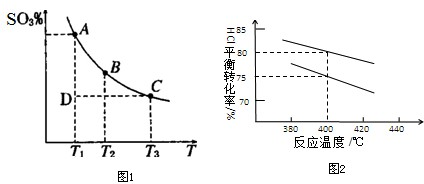
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com