
 2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g);△H<0,550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。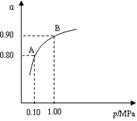
 2SO3(g);△H<0的正反应为放热反应。所以为了提高原料的利用率,反应应该在低温下进行。该反应的正反应为气体体积减小的反应。增大压强能使平衡正向移动,反应物的转化率提高,但是由于增大压强对设备需要承受压强的要求提高,需要的动力也增大,这就需要增大投入,但是制取的物质收益甚微,相对来说,不划算。而且在使用常压SO2就可以达到较高的转化率。在反应开始时c (SO2)=0.4mol/L;c(O2)=0.2mol/L。由于反应达平衡后,体系总压强为0.10 M Pa,此时SO2的平衡转化率为0.8.则平衡时c (SO2)=0.08mol/L;c(O2)=0.04mol/L;c (SO3)=0.32mol/L;因此该反应的化学平衡常数K=
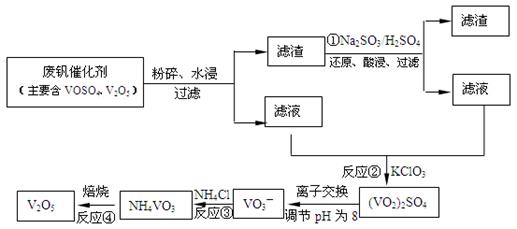
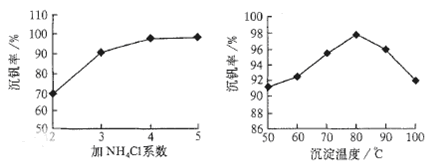
2SO3(g);△H<0的正反应为放热反应。所以为了提高原料的利用率,反应应该在低温下进行。该反应的正反应为气体体积减小的反应。增大压强能使平衡正向移动,反应物的转化率提高,但是由于增大压强对设备需要承受压强的要求提高,需要的动力也增大,这就需要增大投入,但是制取的物质收益甚微,相对来说,不划算。而且在使用常压SO2就可以达到较高的转化率。在反应开始时c (SO2)=0.4mol/L;c(O2)=0.2mol/L。由于反应达平衡后,体系总压强为0.10 M Pa,此时SO2的平衡转化率为0.8.则平衡时c (SO2)=0.08mol/L;c(O2)=0.04mol/L;c (SO3)=0.32mol/L;因此该反应的化学平衡常数K=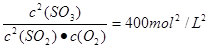 (3)在废钒催化剂中主要含VOSO4、V2O5,经过粉碎、水浸、过滤得到的滤渣中含有V2O5。向其中加入Na2SO3、H2SO4,经过氧化还原反应,V2O5变为可溶于水的VOSO4,留在滤液中。向滤液中加入KClO3,发生氧化反应反应,得到(VO2)2SO4。在(VO2)2SO4、VO3—、NH4VO3及V2O5中V的化合价都是+5价,化合价不变,所以是非氧化还原反应。因此反应①②③④中属于氧化还原反应的是①② 其中反应③的离子方程式为NH4+ + VO3-=NH4VO3↓ 。根据题目提供的图像可知:控制氯化铵系数是4;温度为80℃ 。这时沉钒率最高。
(3)在废钒催化剂中主要含VOSO4、V2O5,经过粉碎、水浸、过滤得到的滤渣中含有V2O5。向其中加入Na2SO3、H2SO4,经过氧化还原反应,V2O5变为可溶于水的VOSO4,留在滤液中。向滤液中加入KClO3,发生氧化反应反应,得到(VO2)2SO4。在(VO2)2SO4、VO3—、NH4VO3及V2O5中V的化合价都是+5价,化合价不变,所以是非氧化还原反应。因此反应①②③④中属于氧化还原反应的是①② 其中反应③的离子方程式为NH4+ + VO3-=NH4VO3↓ 。根据题目提供的图像可知:控制氯化铵系数是4;温度为80℃ 。这时沉钒率最高。

科目:高中化学 来源:不详 题型:单选题
| | 实 验 | 现 象 | 离子方程式 |
| A |  | 在空气中放置一段时间后溶液呈蓝色 | 4H+ + 4I- + O2 ="=" 2I2 + 2H2O |
| B |  | 开始时无气泡,后来有气泡 | CO32-+H+=HCO3- HCO3-+H+ ="=" H2O+CO2↑ |
| C |  | 溶液由黄绿色变为无色 | Cl2 + 2OH- ="=" Cl- + ClO- + H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-="=" BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在少量Mg(OH)2悬浊液中滴加氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3·H2O+Mg2+ |
| B.双氧水中滴加2滴FeCl3溶液:Fe3++H2O2=Fe2++O2↑+2H+ |
| C.双氧水加入稀硫酸和KI溶液: H2O2+2H++2I—= I2+ O2↑+2 H2O |
| D.向银氨溶液中加入盐酸:[Ag(NH3)2]++OH﹣+3H+=Ag++2NH4++H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.浓盐酸 | B.质量分数为70%的H2SO4 |
| C.稀硝酸 | D.质量分数为10%的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4 |
B.亚硫酸氢钠溶液呈酸性:HSO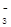 +H2O +H2O H3O++SO H3O++SO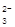 |
| C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
D.稀硝酸洗涤试管内壁的银镜:Ag+2H++NO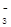 =Ag++NO↑+H2O =Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 醋酸钠溶于水:CH3COO-+H2O===" " CH3COOH+OH- | 正确 |
| B | 在氢氧化钠溶液中滴加少量氯化铝: Al3++3OH-===Al(OH)3↓ | 错误,Al(OH)3能溶于氢氧化钠 |
| C | 铁加入到过量的稀硝酸溶液中:3Fe + 8H++2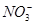 ===3Fe2++ 2NO↑ + 4H2O ===3Fe2++ 2NO↑ + 4H2O | 正确 |
| D | 在硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀的物质的量最多:3Ba2++6OH-+2Al3++3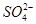 === 3BaSO4↓+2Al(OH)3↓ === 3BaSO4↓+2Al(OH)3↓ | 错误,Al3+与OH-的化学计量数之比为1∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-="2" AlO2-+H2O |
| B.二氧化锰与浓盐酸混合加热:MnO2+2Cl-+2H+=Cl2↑+Mn2++H2O |
| C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O |
| D.硫酸氢钠溶液中滴入Ba(OH)2溶液使所得溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.大理石与盐酸反应:CO32-+ 2H+=H2O+CO2↑ |
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+ |
| D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C.硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+ |
| D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com