
【题目】化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热量的形式表现出来,叫做反应热.由于反应的情况不同,反应热可分为许多种,如标准燃烧热和中和反应反应热等.
(1)下列△H表示物质标准燃烧热的是 ;表示中和反应反应热的是 .(填“△H1”、“△H2”、“△H3”等)
A.2H2(g)+O2(g)═2H2O(l)△H1B.C(s)+![]() O2(g)═CO(g)△H2=﹣Q1kJmol﹣1
O2(g)═CO(g)△H2=﹣Q1kJmol﹣1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3D.C(s)+O2(g)═CO2(g)△H4=﹣Q2kJmol﹣1
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5
(2)2.00g C2H2气体完全燃烧生成液态水和CO2气体,放出99.6kJ的热量,写出该反应的热化学方程式: .
(3)根据题(1)中B、D判断1molCO(g)完全燃烧的△H= .
(4)反应E的△H6可以用如图所示的装置进行测量.实验中直接测定的数据是 ;从实验装置上看,图中尚缺少的一种玻璃用品是 ;大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值 (填“偏大”“偏小”或“无影响”).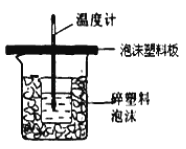
【答案】△H4;△H5;2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=﹣2589.6kJ?mol﹣1;(Q1﹣Q2)kJ?mol﹣1;温度;环形玻璃搅拌棒;偏小
【解析】(1)A.2H2(g)+O2(g)═2H2O(l)△H1中氢气的物质的量不是1mol,所以△H1不能表示燃烧热,故A错误;
B.C(s)+![]() O2(g)═CO(g)△H2=﹣Q1kJmol﹣1 , 生成产物不是最稳定氧化物,所以△H2不能表示燃烧热,故B错误;
O2(g)═CO(g)△H2=﹣Q1kJmol﹣1 , 生成产物不是最稳定氧化物,所以△H2不能表示燃烧热,故B错误;
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H3 , 生成水为气体,不是最稳定氧化物,所以△H3不能表示燃烧热,故C错误;
D.C(s)+O2(g)═CO2(g)△H4=﹣Q2kJmol﹣1 , 碳的物质的量为1mol生成物二氧化碳为稳定氧化物,所以△H5能表示燃烧热,故D正确;
E.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H5 , 符合中和热定义,△H5能表示中和反应反应热,故E正确;
所以答案是:△H4;△H5;
(2)C2H2气体完全燃烧反应的化学方程式为:2C2H2+5O2 ![]() 4CO2+2H2O,2.00g C2H2气体n(C2H2)=
4CO2+2H2O,2.00g C2H2气体n(C2H2)=![]() mol,放出99.6kJ的热量,则1molC2H2燃烧放出的热量为:99.6kJ×13=1294.8KJ,则热化学方程式为:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=﹣2589.6kJmol﹣1;
mol,放出99.6kJ的热量,则1molC2H2燃烧放出的热量为:99.6kJ×13=1294.8KJ,则热化学方程式为:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=﹣2589.6kJmol﹣1;
所以答案是:2C2H2(g)+5O2=4CO2(g)+2H2O(l)△H2=﹣2589.6kJmol﹣1;
(3)依据盖斯定律D﹣B的CO(g)+![]() O2(g)=CO2(g),所有反应的焓变为△H=(Q1﹣Q2)kJmol﹣1;
O2(g)=CO2(g),所有反应的焓变为△H=(Q1﹣Q2)kJmol﹣1;
所以答案是:(Q1﹣Q2)kJmol﹣1;
(4)反应E的△H6可以用如图所示的装置进行测量.实验中直接测定的数据是温度;
量热计应带环形玻璃搅拌棒;大烧杯上如不盖硬纸板,导致热量损失,所有求得的中和反应的反应热的数值偏小;
所以答案是:温度;环形玻璃搅拌棒;偏小.
【考点精析】本题主要考查了燃烧热的相关知识点,需要掌握在101kPa时1mol H2物质完全燃烧生成稳定的氧化物时所放出的能量,叫该物质的燃烧热才能正确解答此题.


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有关其说法正确的是( )
Cd(OH)2+2Ni(OH)2有关其说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.放电时负极附近溶液的碱性不变
C.放电时电解质溶液中的OH﹣向正极移动
D.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣=NiOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25℃、101kPa下,1g C8H18(l)燃烧生成CO2和液态H2O时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
O2(g)═8CO2(g)+9H2O(g)△H=﹣48.40 kJmol﹣1
B.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJmol﹣1
O2(g)═8CO2(g)+9H2O(l)△H=﹣5 517.6 kJmol﹣1
C.C8H18(l)+ ![]() O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJmol﹣1
O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJmol﹣1
D.2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=﹣5 517.6 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃在酸性KMnO4溶液中双键断裂形式为: 
![]()
 现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2﹣COOH,由此推断此二烯可能的结构简式为( )
现有二烯烃C10H18与酸性KMnO4溶液作用后可得到三种有机物:(CH3)2CO、CH3COOH、CH3CO(CH2)2﹣COOH,由此推断此二烯可能的结构简式为( )
A.(CH3)2C═C(CH3)CH2CH2CH═CH CH2CH3
B.(CH3)2C═CHCH2CH2C(CH3)═CHCH3
C.CH3CH═C(CH3)CH2CH2CH2C(CH3)═CH2
D.CH3CH═C(CH3)CH2CH2CH2CH═CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1mol H﹣O键形成时放出热量463kJ,则氢气中1mol H﹣H键断裂时吸收热量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组准备用环己醇制备环己烯,查得相关资料如下.反应原理:  反应物与产物的物理性质:
反应物与产物的物理性质:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)实验过程中可能发生的有机副反应的方程式为 .
(2)根据上述资料,装置(A,B,C)最适宜用来完成本次制备实验. 
(3)制备粗产品 将5mL加入试管A中,再加入10m , 摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯 ①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是;分液时,环己烯应从分液漏斗的(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是( ) 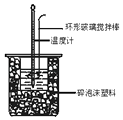
A.改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同
B.酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
C.装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失
D.实验中应记录测量出的最高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质保存的说法正确的组合是( )
①钠应该密封在煤油中保存;②过氧化钠可以露置在空气中保存;③氯水应该密封在无色试剂瓶中保存;④漂白粉不能露置在空气中保存。
A.①③B.①②③④C.①③④D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com