
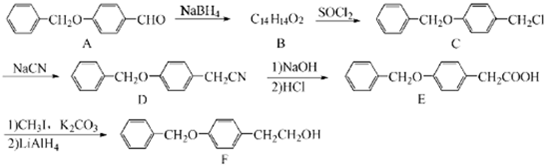
 ;由C→D的反应类型是:取代反应.
;由C→D的反应类型是:取代反应. .
. 为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
为原料制备化合物X(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:CH3CHO$→_{催化剂△}^{O_{2}}$CH3COOH$→_{浓硫酸△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
分析 A含有的官能团为醚键和醛基,对比A、C的结构简式可知B为 ,B与SOCl2发生取代反应生成
,B与SOCl2发生取代反应生成 ,然后与NaCN发生取代反应生成
,然后与NaCN发生取代反应生成 ,经水解、还原,最终生成
,经水解、还原,最终生成 ;
;
以 制备
制备 ,可在浓硫酸作用下生成
,可在浓硫酸作用下生成 ,然后与HCl发生加成反应生成
,然后与HCl发生加成反应生成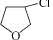 ,与NaCN发生取代反应生成
,与NaCN发生取代反应生成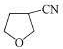 ,在催化作用下与氢气反应可生成
,在催化作用下与氢气反应可生成 ,以此解答该题.
,以此解答该题.
解答 解:A含有的官能团为醚键和醛基,对比A、C的结构简式可知B为 ,B与SOCl2发生取代反应生成
,B与SOCl2发生取代反应生成 ,然后与NaCN发生取代反应生成
,然后与NaCN发生取代反应生成 ,经水解、还原,最终生成
,经水解、还原,最终生成 ,
,
(1)由结构简式可知A含有的官能团为醚键和醛基,故答案为:醚键、醛基;
(2)B为 ,
, 与NaCN发生取代反应生成
与NaCN发生取代反应生成 ,
,
故答案为: ;取代反应;
;取代反应;
(3)E的一种同分异构体含有3种不同化学环境的氢,且含有2个苯环,且结构对称,则对应的结构有 ,
,
故答案为: ;
;
(4)以 制备
制备 ,可在浓硫酸作用下生成
,可在浓硫酸作用下生成 ,然后与HCl发生加成反应生成
,然后与HCl发生加成反应生成 ,与NaCN发生取代反应生成
,与NaCN发生取代反应生成 ,在催化作用下与氢气反应可生成
,在催化作用下与氢气反应可生成 ,也可与HCl反应生成
,也可与HCl反应生成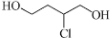 ,再生成
,再生成 ,
,
则流程为 ,
,
故答案为: .
.
点评 本题为2015年江苏卷第17题,涉及有机物的合成,侧重于学生的分析能力的考查,答题时注意把握提给信息以及官能团的性质,注意合成路线的设计,为解答该题的难点.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为17、中子数为20的氯原子${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: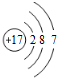 | |
| C. | 氯分子的电子式: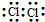 | |
| D. | 氯乙烯分子的结构简式:H3C-CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Na2CO3溶液中CO32-的水解:CO32-+H2O=HCO3-+OH- | |
| C. | 酸性溶液中KIO3与KI反应生成I2:IO3-+I-+6H+=I2+3H2O | |
| D. | NaHCO3溶液中加足量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3
已二酸是一种重要的有机二元酸,主要用于制造尼龙66纤维和尼龙66树脂,在实验室中可通过环己醇的氧化反应来制备.反应原理:3 +8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.
+8HNO3$\stackrel{一定条件}{→}$3HOOC(CH2)4COOH+8NO↑+7H2O,反应装置(部分夹持装置和热源已省略)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(so3)/mol | 0 | 0.6 | 1.2 | 1.8 | 1.8 |
| A. | 反应在前t1s的平均速率v(O2)=0.3/t1 mol•L-1•s-1 | |
| B. | 该温度下反应平衡常数为1.62×10-3L/mol | |
| C. | 相同温度下,起始时向容器中充入4 mol SO3,达到平衡时,SO3的转化率大于10% | |
| D. | 温度不变,向该容器中再充入0.2 mol SO2、0.1 mol O2,1.8 mol SO3反应达到新平衡时SO3转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)金刚石和石墨的晶胞如图,若碳原子半径为a cm 且相邻最近的碳原子相切,阿伏加德罗常数为NA,则金刚石的密度表达式为(要求整理为分母不含根号的表达式)$\frac{9\sqrt{3}}{1{6a}^{3}{N}_{A}}$g/cm3,一个石墨晶胞内含有4个碳原子,石墨的熔点比金刚石的熔点要高,其原因是石墨中碳碳键长小于金刚石中碳碳键长,这两种晶胞中碳的配位数(每个碳周围与之最近的碳原子数)之比为4:3.
(1)金刚石和石墨的晶胞如图,若碳原子半径为a cm 且相邻最近的碳原子相切,阿伏加德罗常数为NA,则金刚石的密度表达式为(要求整理为分母不含根号的表达式)$\frac{9\sqrt{3}}{1{6a}^{3}{N}_{A}}$g/cm3,一个石墨晶胞内含有4个碳原子,石墨的熔点比金刚石的熔点要高,其原因是石墨中碳碳键长小于金刚石中碳碳键长,这两种晶胞中碳的配位数(每个碳周围与之最近的碳原子数)之比为4:3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com