
| A. | 耐火陶瓷可以选用熔点很高的 Al2O3等材料制作 | |
| B. | 含量为 99.9999%的高纯硅用于制作光导纤维 | |
| C. | 高炉炼铁可用铝热反应来迚行冶炼 | |
| D. | “雷雨肥田“是因为 N2不O2在放电条件下生成氮的化合物 |
分析 A.氧化铝熔点较高,可作耐火材料;
B.光导纤维主要成分是二氧化硅;
C.依据高炉炼铁原理解答;
D.氮气与氧气在放电条件下反应生成一氧化氮,一氧化氮氧化生成二氧化氮,二氧化氮与水反应生成硝酸,硝酸生成能够被植物吸收的硝酸盐.
解答 解:A.氧化铝熔点较高,一般条件下不易熔化,所以是一种比较好的耐火材料,可用来制造耐火坩埚,故A正确;
B.二氧化硅具良好的光学特性,光导纤维主要成分是二氧化硅,故B错误;
C.原理是一氧化碳把铁从铁矿石(主要成分是三氧化二铁)里还原出来,还原为铁和二氧化碳,故C错误;
D.“雷雨肥田“是因为 N2不O2在放电条件下生成氮的化合物,故D正确;
故选:AD.
点评 本题考查了物质的性质与用途、高炉炼铁的原理等,熟悉氧化铝、二氧化硅、氮气及其氧化物性质是解题关键,题目难度不大.注意硅与二氧化硅用途,为高考频考点.


科目:高中化学 来源: 题型:选择题
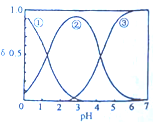 H2C2O4水溶液中H2C2O4、HC2O${\;}_{4}^{-}$和C2O${\;}_{4}^{2-}$三种粒子的分布分数δ随溶液pH的变化如图所示,下列说法不正确的是 ( )
H2C2O4水溶液中H2C2O4、HC2O${\;}_{4}^{-}$和C2O${\;}_{4}^{2-}$三种粒子的分布分数δ随溶液pH的变化如图所示,下列说法不正确的是 ( )| A. | 曲线②代表的粒子是HC2O4- | |
| B. | 0.1mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,离子浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体c(C2O42-)减小c(Ca2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑ | |
| B. | 热还原法:Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 | |
| C. | 热分解法:2Al2O3═4Al+3O2↑ | |
| D. | 物理方法:利用密度大的性质水洗矿物提取金 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
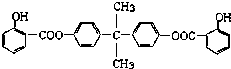
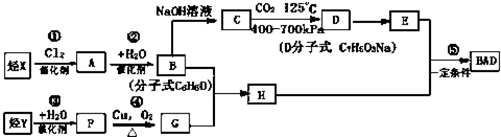
 .
. .F+E
.F+E .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化是在一定条件下使煤和氢气作用,把煤转化成液体燃料的过程 | |
| B. | 石油中含有C5~C12的烷烃,可以通过石油的分馏得到汽油 | |
| C. | 蒙古牧民喜欢用银器盛放鲜牛奶有其科学道理:用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 | |
| D. | 检验淀粉水解产物中有没有葡萄糖,可以在水解后的溶液中直接加新制氢氧化铜来检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
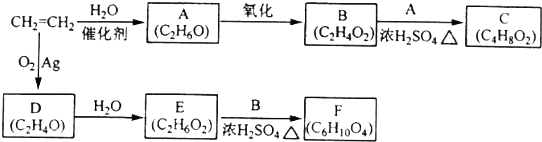
 ;
;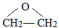 ;
;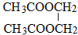 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按照系统命名法,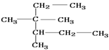 的名称为2,3-二甲基-2-乙基戊烷 的名称为2,3-二甲基-2-乙基戊烷 | |
| B. | 除去苯中 的方法:加溴水,充分振荡,静置分液 的方法:加溴水,充分振荡,静置分液 | |
| C. | 1mol 最多能与4mol氢氧化钠反应 最多能与4mol氢氧化钠反应 | |
| D. | 苯乙烯中所有原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌与稀硫酸反应:Zn+2H+═Zn2++H2↑ | |
| B. | FeCl3溶液中加入氢氧化钠溶液:Fe3++3OH-═Fe(OH)3(胶体) | |
| C. | Ca(NO3)2溶液中滴加少量的Na2CO3溶液:Ca2++CO32-═CaCO3↓ | |
| D. | 常温下氯气与苛性钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
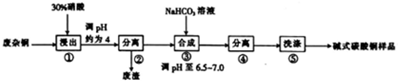
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com