
| A. | 保证装置不漏气 | |
| B. | 镁带称量后,用砂皮擦去表面的氧化层 | |
| C. | 用针筒注入硫酸后,拔出速度要快 | |
| D. | 镁带的质量要使产生的氢气足以计量 |
分析 根据Mg+H2SO4→MgSO4+H2↑,氢气的物质的量等于镁的物质的量,将氢气的物质的量转化为测定镁的物质的量,即测定镁的质量,由直接测量改为间接测量,那么此时VM的计算公式就变为了VM=V(H2)×$\frac{M(Mg)}{m(Mg)}$,也就是说此时我们要想测定VM,就要测出镁带的质量,以及生成氢气的体积.
解答 解:A.保证装置不漏气,装置漏气,测出气体的体积偏小,故A正确;
B.氧化镁与酸反应不生成氢气,应在称量前擦去,故B错误;
C.用针筒注入硫酸后,拔出速度要快,以免氢气溢出,故C正确;
D.镁带的质量要使产生的氢气足以计量,量太少,无法测量,且误差较大,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及测量试验的探究等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 7.1gCl2与足量的氢氧化钠溶液反应生成NaClO转移的电子数为0.1NA | |
| B. | 1molNa与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为NA | |
| C. | 常温常压下,32gO2和O3的混合气体所含原子数为2NA | |
| D. | 标准状况下,足量Fe与22.4LCl2反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
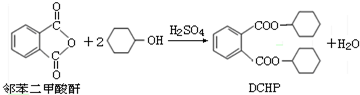
| A. | 邻苯二甲酸酐的二氯代物有2种 | |
| B. | 环己醇分子中所有的原子可能共平面 | |
| C. | DCHP能发生加成反应、取代反应、消去反应 | |
| D. | 1molDCHP可与氢氧化钠溶液反应,最多可消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁跟稀硫酸反应:2Fe+6H+→2Fe3++3H2↑ | |
| B. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2→Fe3++2Cl- | |
| C. | 盐酸滴入氢氧化钡溶液中:H++OH-=H2O | |
| D. | 氯气通入NaOH溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可保存在带玻璃塞的玻璃瓶中 | |
| B. | 钠保存在煤油中 | |
| C. | 液氯可以保存钢瓶中 | |
| D. | 过氧化钠、漂白粉要密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )
某有机物的结构简式如下所示,则下列关于该有机化合物的各项叙述正确的是( )| A. | 该有机物遇氯化铁溶液不呈紫色 | |
| B. | 1mol该有机物能与6mol氢氧化钠反应 | |
| C. | 该有机物能与6mol金属钠反应生成6molH2 | |
| D. | 在稀硫酸存在下可以发生水解反应,但水解的产物只有一种有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com