
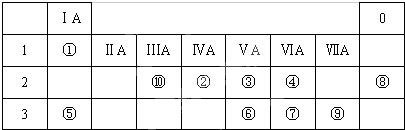
���� ��Ԫ�������ڱ���λ�ã���֪��ΪH����ΪC����ΪN����ΪS����ΪNa����ΪP����ΪS����ΪNe����ΪCl����ΪAl��
��1����Ԫ�طǽ���ǿ����õ��ӣ����������ԣ�
��2���ǽ�����Խǿ����Ӧ�⻯��Խ�ȶ���
��3������ˮ��Ӧ��������������������
��4��Ԫ�آ�����������ΪAl2O3���ݵ�����������Ӧ��ˮ����ΪNaOH�����߷�Ӧ����ƫ��������ˮ��
��5��ͬ�����������Ԫ�طǽ�������ǿ������������ۺ����������ǿ����Ԫ�ص���֮����û��Ƚ�����֤��
��� �⣺��Ԫ�������ڱ���λ�ã���֪��ΪH����ΪC����ΪN����ΪS����ΪNa����ΪP����ΪS����ΪNe����ΪCl����ΪAl��
��1����Ԫ�طǽ���ǿ����õ��ӣ��������������ԣ��ʴ�Ϊ�������ԣ�
��2���ǽ�����O��S��P���ǽ�����Խǿ����Ӧ�⻯��Խ�ȶ������⻯���ȶ��ԣ�H2O��H2S��PH3���ʴ�Ϊ��H2O��H2S��PH3��
��3������ˮ��Ӧ����������������������Ӧ����ʽΪ��2Na+2H2O=2NaOH+H2�����ʴ�Ϊ��2Na+2H2O=2NaOH+H2����
��4��Ԫ�آ�����������ΪAl2O3���ݵ�����������Ӧ��ˮ����ΪNaOH�����߷�Ӧ����ƫ��������ˮ����Ӧ���ӷ���ʽΪ��Al2O3+2OH-=2AlO2-+H2O���ʴ�Ϊ��Al2O3+2OH-=2AlO2-+H2O��
��5��ͬ�����������Ԫ�طǽ�������ǿ��ClԪ�ػ�ѧ���ʸ����ã�HClO4����ǿ��H2SO4���ܷ�����Ӧ��Cl2+H2S=2 HCl+S���Ⱦ�������֤��Ԫ�ػ�ѧ���ʻ��ã�
�ʴ�Ϊ��Cl��HClO4����ǿ��H2SO4���ܷ�����Ӧ��Cl2+H2S=2 HCl+S����
���� ���⿼��Ԫ�����ڱ���Ԫ�������ɣ��ѶȲ���ע�����ս����ԡ��ǽ�����ǿ���Ƚ�ʵ����ʵ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��Na+����c��HRO3-����c��H+����c��RO32-����c��OH-�� | |
| B�� | c��Na+��+c��H+���Tc��HRO3-��+c��RO32-��+c��OH-�� | |
| C�� | c��RO32-��+c��HRO3-��+c��H2RO3���Tc��Na+�� | |
| D�� | ����Һ��c��Na+����c��HRO3-����c��RO32-���ֱ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CO | H2 | CH3OH |
| Ũ�ȣ�mol•L-1�� | 0.9 | 1.0 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | m��n | B�� | m=n | C�� | m��n | D�� | ��ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
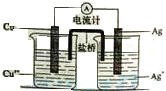 ����һ�ֹ�������Ŵ�����������Ǯ�Ҽ�װ�������ִ��ڵ�غ��������ĵ��������й㷺Ӧ�ã��ش��������⣮
����һ�ֹ�������Ŵ�����������Ǯ�Ҽ�װ�������ִ��ڵ�غ��������ĵ��������й㷺Ӧ�ã��ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com