
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。
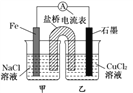
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式:_____________________,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是,“溶液中的十3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:________________________________。
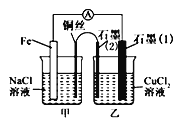
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是_______________,电极反应为________________;乙装置中石墨(1)为_______(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为______________________。
【答案】 0.2 2H++2e-===H2↑ 2Fe2++Cl2===2Fe3++2Cl- 2Fe3++3Cl2+8H2O===2FeO![]() +6Cl-+16H+ 溶液变红 O2+2H2O+4e-===4OH- 阴 2Cl--2e-===Cl2↑
+6Cl-+16H+ 溶液变红 O2+2H2O+4e-===4OH- 阴 2Cl--2e-===Cl2↑
【解析】
(1)设计的原电池装置的自发氧化还原反应是:![]() ,设电子转移量是xmol,则
,设电子转移量是xmol,则![]() ,计算得出
,计算得出![]() ,
,
因此,本题正确答案是:0.2。;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,实质是:![]()
![]()
![]() ,正极发生
,正极发生![]() ↑,用吸管吸出铁片附近溶液即
↑,用吸管吸出铁片附近溶液即![]() 的溶液,加入氯水发生
的溶液,加入氯水发生![]() ═
═![]() ,如果+3价铁被氧化为
,如果+3价铁被氧化为![]() ,发生
,发生![]() ═
═![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ↑;
↑;![]() ═
═![]() ;
;![]() ═
═![]() ;
;
(3)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,铁为负极,铜为正极,正极发生![]() ═
═![]() ,呈碱性,滴加酚酞,溶液变红,则乙装置与铜相连的石墨为阳极,与铁相连的石墨为阴极,乙为电解池装置,阳极发生
,呈碱性,滴加酚酞,溶液变红,则乙装置与铜相连的石墨为阳极,与铁相连的石墨为阴极,乙为电解池装置,阳极发生![]() ═
═![]() ↑。因此,本题正确答案是:溶液变红;
↑。因此,本题正确答案是:溶液变红;![]() ═
═![]() ;阴;
;阴;![]() ═
═![]() ↑
↑
点睛:(1)根据自发氧化还原反应知识来书写,并根据两极反应结合两极质量变化进行计算;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,正极生成氢气;用吸管吸出铁片附近溶液即![]() 的溶液,加入氯水发生
的溶液,加入氯水发生![]() ═
═![]() ;
;
(3)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,乙为电解池装置.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是( )
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D. T2℃时,若反应达平衡后再缩小容器的体积。c(N2)/c(NO)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。
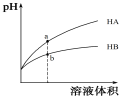
下列说法正确的是
A.同浓度的NaA与NaB溶液中,c(A-) 小于c(B-)
B.a点溶液的导电性大于b点溶液
C.a点的c(HA)大于b点的c(HB)
D.HA 的酸性强于HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铬铁矿主要成分是FeO·Cr2O3,含有FeCO3、SiO2、Fe3O4等杂质,现由该铬铁矿制备强氧化剂Na2Cr2O7的流程如下:
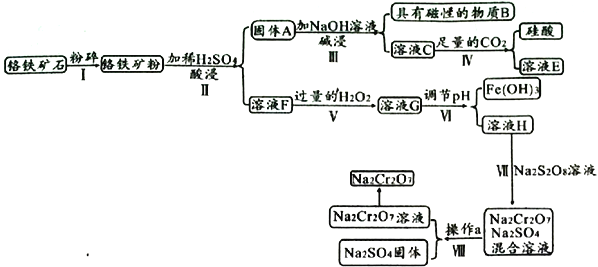
已知:常温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Cr(OH)3]=6.3×10-30
回答下列问题:
(1)物质B为______________,溶液E为____________________。
(2)溶液G中经检测不含H2O2的可能原因是________________________________________。
(3)若步骤Ⅵ调节pH后,c(Cr3+)=6.3mol/L,则pH范围是______________(离子浓度不大于1.0×10-5mol/L即可认为沉淀完全)。
(4)步骤Ⅶ发生的离子方程式为________________________________________。
(5)Na2Cr2O7和Na2SO4的溶解度随温度变化的曲线如下图所示,步骤Ⅷ中操作a为___________、__________________。
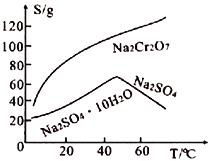
(6)若称取mg该铬铁矿,其中FeO·Cr2O3的质量分数为70%,最终制得ng Na2Cr2O7固体,则该过程中Cr元素的转化率为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铝粉和Fe3O4粉末配成铝热剂并分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是
A. 3∶8 B. 8∶3
C. 3∶4 D. 4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2:326.26.26 联合国将2011年定为“国际化学年”,主题是“化学,人类的生活,人类的未来”,以鼓励青年人热爱化学。学习化学应该明白“从生活中来,到生活中去”的道理。

请填空:
(1)成人每天应从食物中摄取的几种元素的质量分别为: Mg 300 mg、Ca 800 mg、Fe 14 mg、Cu 1.6 mg,这些元素的物质的量之比为_________。
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,计算出该注射液中葡萄糖的物质的量浓度为__________。
(3)SO2有毒,但葡萄酒里都含有微量SO2,起保鲜、杀菌和抗氧化作用,抗氧化作用利用了SO2的_______性。“硅胶”常用作实验室和袋装食品、瓶装药品等的干燥剂,也可以用作_______的载体。实验室可用________溶液来鉴别某未知液是苏打水还是水玻璃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
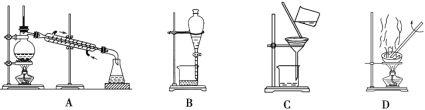
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________(填“上”或“下”)口进水。装置B在操作时为使液体顺利滴下,除打开下端活塞外,还应进行的具体操作是________________________________。
(4)为了除去KCl中的Ca2+、Mg2+、![]() 及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是___________。
及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是___________。
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥加过量KOH溶液 ⑦加过量K2CO3溶液
A.②⑤④①③ B.⑥⑤⑦①③ C.④①②⑤③ D.④②⑤①③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com