
| A. | ac | B. | be | C. | df | D. | gh |
分析 a.F2淡黄绿色,Cl2黄绿色,Br2红棕色,I2紫黑色;
b.都是分子量越大,熔点越高,密度越大;
c.分子晶体,分子量越大,熔点与沸点逐渐升高;
d.非金属性越强,单质X2的氧化性越强;
e.非金属性越强,HX稳定性越强;
f.非金属性越强,对应离子X-还原性越弱;
g.非金属性越强,与H2反应容易;
h.非金属性越强,与水反应越容易.
解答 解:a.F2淡黄绿色,Cl2黄绿色,Br2红棕色,I2紫黑色,所以单子颜色逐渐加深,故正确;
b.都是分子量越大,熔点越高,密度越大,故正确;
c.分子晶体,分子量越大,熔点与沸点逐渐升高,故正确;
d.非金属性越强,对单质X2的氧化性越强,而F、Cl、Br、I的非金属性减弱,所以氧化性减弱,故错误;
e.非金属性越强,HX稳定性越强,而F、Cl、Br、I的非金属性减弱,所以HX稳定性减弱,故正确;
f.非金属性越强,对应离子X-还原性越弱,而F、Cl、Br、I的非金属性减弱,所以X-还原性增强,故错误;
g.非金属性越强,与H2反应容易,而F、Cl、Br、I的非金属性减弱,所以与H2反应逐渐困难,故正确;
h.非金属性越强,与水反应越容易,而F、Cl、Br、I的非金属性减弱,所以与水反应逐渐困难,故正确;故选C.
点评 本题考查卤素性质的变化规律,学生只要掌握元素周期律的相关知识,就可以迅速解题,比较容易.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g)△H=-92.0 kJ•mol-1,吸收的能量为46.0 kJ,则形成N-H键的数目为3NA | |
| B. | 常温下,向一密闭容器中加入2molNO与1molO2,容器中的分子数目小于2NA | |
| C. | 18gD2O(2H2O)中,含有的中子总数为10NA | |
| D. | 1.0mol•L-1NaCl溶液中含有NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔的电子式: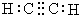 | B. | 乙烯的结构简式为:CH2CH2 | ||
| C. | 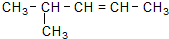 命名为4-甲基-2-戊烯 命名为4-甲基-2-戊烯 | D. | 苯分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SO4>HClO4 | B. | 氧化性:Fe3+>Fe2+ | ||
| C. | 稳定性:HBr<HCl | D. | 原子半径 Na>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L N2和11g CO2 | B. | 5g CO和5g H2 | ||
| C. | 含1mol H原子的H2O和0.5mol Br2 | D. | 质子数相等的NH3和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol•L-1 K2Cr2O2溶液中Cr2O72-的数目为NA | |
| B. | 1mol C60F60分子中碳原子之间共用电子对数目为90NA | |
| C. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| D. | 标准状况下,2.24L Cl2完全溶于水,转移电子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水中加入盐酸:Ca(OH)2+2H+═2H2O+Ca2+ | |
| B. | 硫酸与氢氧化钡溶液反应:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| C. | 碳酸氢钙和过量的氢氧化钠溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| D. | 铁与氯化铁溶液反应:Fe+2Fe3+═3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质$\left\{\begin{array}{l}{混合物}\\{纯净物\left\{\begin{array}{l}{溶液}\\{化合物}\end{array}\right.}\end{array}\right.$ | B. |  | ||
| C. | 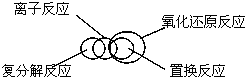 | D. | 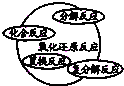 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Na在氧气中完全燃烧所得产物的电子式为
,Na在氧气中完全燃烧所得产物的电子式为

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com