
| A. | 在Na2S溶液中:c(Na+)=c(HS-)+c(S2-) | |
| B. | 乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-akJ•mol-1 | |
| C. | 钢铁发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH- | |
| D. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
分析 A.根据硫化钠溶液中的物料守恒分析;
B.乙烯的燃烧热为乙烯生成二氧化碳气体和液体水时放出的热量,若生成气体水,放热的热量减少;
C.钢铁的吸氧腐蚀中,正极氧气得到电子生成氢氧根离子;
D.酸性条件下,反应产物不会为氢氧根离子.
解答 解:A.根据Na2S溶液中的物料守恒可得:c(Na+)=2c(HS-)+2c(S2-)+2c(H2S),故A错误;
B.乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的正确的热化学方程式为:C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-akJ•mol-1,故B错误;
C.钢铁发生吸氧腐蚀的正极氧气得到电子生成氢氧根离子,电极反应式为:O2+4e-+2H2O=4OH-,故C正确;
D.用过氧化氢从酸化的海带灰浸出液中提取碘,反应生成碘单质和水,正确的离子方程式为:2I-+H2O2+2H+═I2+2H2O,故D错误;
故选C.
点评 本题考查了离子浓度大小比较、热化学方程式的书写、离子方程式的判断、原电池原理及电极反应式书写等知识,题目难度中等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用基础知识的能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①② | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
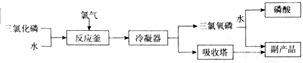
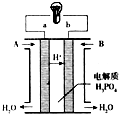
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 有些活泼金属如铝可用作热还原法的还原剂 | |
| D. | 金属在地壳中含量很高,回收废旧金属浪费人力物力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
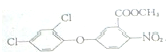
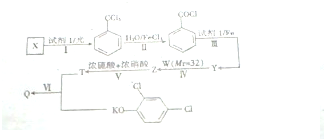

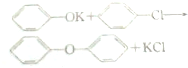
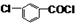 +CH3OH→
+CH3OH→ +HCl.
+HCl. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
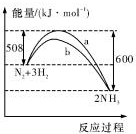
| A. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92kJ.mol-1 | |
| B. | 生成物的能量之和比反应物的能量之和高 92 kJ | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增加正反应速率,减小逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li在N2中燃烧生成Li3N | |
| B. | LiOH是极易溶的强碱 | |
| C. | Be(OH)2既能溶于强酸又能溶于强碱溶液 | |
| D. | 硼酸钠溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
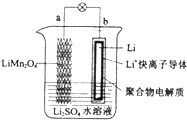
| A. | a为电池的正极 | B. | 放电时,b极电极反应式:Li-e-=Li+ | ||
| C. | 放电时,a极锂的化合价发生变化 | D. | 放电时,溶液中Li+从b向a迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com