
| A. | 用酸性高锰酸钾溶液鉴别乙烷和乙烯 | |
| B. | 用分液漏斗分离乙醛和水 | |
| C. | 用苯、溴水和铁粉混合制取溴苯 | |
| D. | 用紫色石蕊溶液检验苯酚弱酸性 |
分析 A.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙烷性质较稳定,和酸性高锰酸钾溶液不反应;
B.互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏的方法分离;
C.苯和溴水不反应,和液溴在溴化铁作催化剂条件下发生取代反应;
D.苯酚酸性很弱,不能使石蕊溶液变色.
解答 解:A.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,乙烷性质较稳定,和酸性高锰酸钾溶液不反应,所以可以用酸性高锰酸钾溶液鉴别乙烷和乙烯,故A正确;
B.互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏的方法分离,乙醛和水互溶,应该采用蒸馏方法分离,故B错误;
C.苯和溴水不反应,和液溴在溴化铁作催化剂条件下发生取代反应,所以该实验不能实现实验目的,故C错误;
D.苯酚俗称石炭酸,酸性很弱,不能使石蕊溶液变色,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及物质鉴别、物质分离和提纯、物质反应条件等知识点,明确实验原理及物质性质是解本题关键,侧重考查学生实验操作及实验评价能力,注意基础知识的总结和归纳.


科目:高中化学 来源: 题型:选择题
| A. | 加入Al能放出H2的溶液中:NH4+,SO42-,Br-,NO3- | |
| B. | 通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ | |
| C. | 无色强酸性溶液中:Na+、Cl-、SO42-、Cu2+ | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子的最外层电子数依次增多 | |
| B. | Si、P、S元素的最高正价依次升高 | |
| C. | C、N、O的原子半径依次增大 | |
| D. | Li、Na、K的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
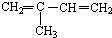 与Br2按物质的量之比1:1发生1,4加成反应的化学方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br.
与Br2按物质的量之比1:1发生1,4加成反应的化学方程式CH2=C(CH3)CH=CH2+Br2→CH2BrC(CH3)=CHCH2Br. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | ① | ② | ③ | ④ |
| 装置 | 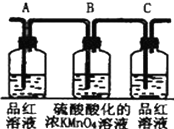 | 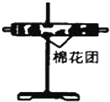 |  |  |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O
CH3COOC2H5+H2O ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 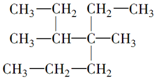 4-甲基-4,5-二乙基乙烷 4-甲基-4,5-二乙基乙烷 | B. | 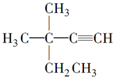 3,3-二甲基-1-戊炔 3,3-二甲基-1-戊炔 | ||
| C. | 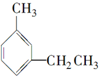 3-甲基乙基苯 3-甲基乙基苯 | D. |  3-甲基-1,3-丁二烯 3-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,OPA分子中最多有16个原子共平面.
,OPA分子中最多有16个原子共平面.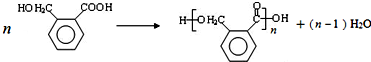 (不必注明反应条件),该反应的类型为缩聚反应.
(不必注明反应条件),该反应的类型为缩聚反应.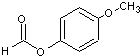 (写出其结构简式).
(写出其结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 制备方法 | 具体内容 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
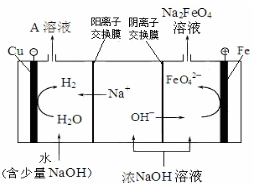
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
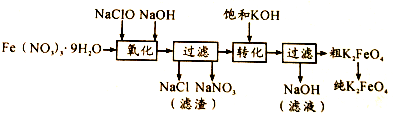
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com