
| A. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 |
分析 置换反应是指由一种单质和一种化合物反应,生成另外一种单质和一种化合物的反应.置换反应的特点是反应物和生成物都是一种单质和一种化合物.
解答 解:A.Fe2O3、CO是两种化合物,该反应是两种化合物反应生成另一种单质和另一种化合物的反应,不属于置换反应,故A错误;
B.反应物Mg、CO2分别是单质、化合物,生成物C、MgO分别是单质、化合物,该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应,故B正确;
C.CuO、HCl是两种化合物,该反应是两种化合物反应生成另外两种化合物的反应,不属于置换反应,故C错误;
D. S、O2是两种单质,该反应是两种单质反应生成一种化合物的反应,不属于置换反应,故D错误;
故选B.
点评 本题考查置换反应的判别,解答本题要充分理解置换反应概念的含义,只有这样才能对反应类型做出正确的判断,题目较简单.


科目:高中化学 来源: 题型:解答题
 草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.
草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的制取和草酸的性质,进行如下实验.| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(S) (g) | 褪色时间(S) | ||
| C(mol•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
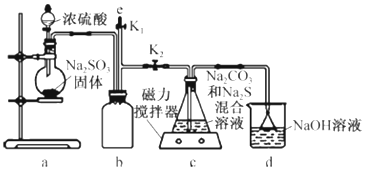
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
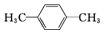 (4)间甲基苯甲醛 (5)CH2=CHCH2CH3(6)
(4)间甲基苯甲醛 (5)CH2=CHCH2CH3(6)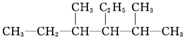
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
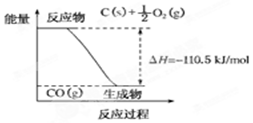
| A. | 12g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ | |
| B. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| C. | 该反应的热化学方程式是2C(s)+O2(g)═2CO(g);△H=-221 kJ | |
| D. | 该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ | ④ |
| m(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| m(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:Fe b:FeCl3 c:FeCl2 | B. | a:AlCl3 b:Al(OH)3 c:Al2O3 | ||
| C. | a:N2 b:NH3 c:NO2 | D. | a:SO2 b:SO3 c:H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com