
A、镁离子结构示意图: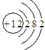 | ||
B、质子数与中子数相等的硫原子:
| ||
C、二氟化氧分子电子式: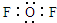 | ||
D、对甲基苯酚结构简式: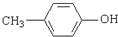 |
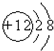 ,故A错误;
,故A错误; ,故C错误;
,故C错误; ,故D正确;
,故D正确;

科目:高中化学 来源: 题型:
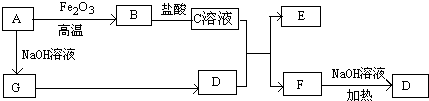
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应2H2O2=2H2O+O2,加入FeCl3或升高温度都能增大反应的活化分子百分数 |
| B、某原电池反应为Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液 |
| C、原电池的两极一定是由活动性不同的两种金属组成,且活泼金属一定作负极. |
| D、向2.0 mL浓度均为0.1 mol?L-1的KCl、KI混合溶液中滴加1~2滴0.01mol?L-1AgNO3溶液,振荡,生成黄色沉淀,说明Ksp(AgI)比Ksp(AgCl)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、四种元素的原子半径:rZ>rX>rY>rw |
| B、X、Y、Z、W形成的单质最多有6种 |
| C、四种元素中,Z的最高价氧化物对应水化物酸性最强 |
| D、四种元素均可与氢元素形成18电子分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3个 | B、4个 | C、5个 | D、6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3═Na++H++CO32- |
| B、Ba(OH)2═Ba2++OH- |
| C、KClO3=K++ClO3- |
| D、H2SO4═H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCO3使人中毒的原因是BaCO3在胃酸作用下,生成可溶性的钡盐,由于Ba2+是重金属离子,能使人体组织蛋白质变性而使人中毒 |
| B、服用生鸡蛋清可以使病人减轻中毒症状 |
| C、由于Ba2+是重金属离子,所以,所有的钡盐都是有毒的 |
| D、变性的蛋白质,加水不能重新溶解,也丧失了原有的生理功能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com