
分析 (1)氢氧化钡溶液和硫酸铜溶液的反应,生成硫酸钡和氢氧化铜;
(2)HCl能和碳酸氢钠反应,而二氧化碳和碳酸氢钠不反应;
(3)NaHSO4与Ba(OH)2以物质的量之比1:1混合,发生NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O;
(4)该离子方程式表示二氧化碳与强碱反应生成可溶性的碳酸盐.
解答 解:(1)氢氧化钡溶液和硫酸铜溶液的反应的离子反应为Ba2++2OH-+Cu2++SO42-=Cu(OH)2↓+BaSO4↓,
故答案为:Ba2++2OH-+Cu2++SO42-=Cu(OH)2↓+BaSO4↓;
(2)HCl能和碳酸氢钠反应,而二氧化碳和碳酸氢钠不反应,故可以饱和碳酸氢钠溶液除去二氧化碳中的HCl气体,反应为:H++HCO3-═H2O+CO2↑,故答案为:H++HCO3-═H2O+CO2↑;
(3)NaHSO4与Ba(OH)2以物质的量之比1:1混合,发生NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,离子反应为H++SO42-+Ba2++OH-=BaSO4↓+H2O,
故答案为:H++SO42-+Ba2++OH-=BaSO4↓+H2O;
(4)该离子方程式表示二氧化碳与强碱反应生成可溶性的碳酸盐,如CO2+2NaOH=Na2CO3+H2O,故答案为:CO2+2NaOH=Na2CO3+H2O.
点评 本题考查化学方程式、离子方程式书写方法和注意问题,反应的实质和产物判断是解题关键,题目较简单.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:解答题
 Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于表:| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、环己烷都属于脂肪烃 | B. | 苯、环戊烷、环己烷同属于芳香烃 | ||
| C. | 乙烯、乙炔同属于烯烃 | D. |  、 、 、 、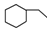 同属于环烷烃 同属于环烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,0.5 mol任何气体的体积都必定是11.2 L | |
| B. | 在标准状况下,1 mol任何物质的体积都约是22.4 L | |
| C. | 常温常压下,1 mol任何气体的体积都约是22.4 L | |
| D. | 在标准状况下,0.5 mol CO2所占有的体积约是11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
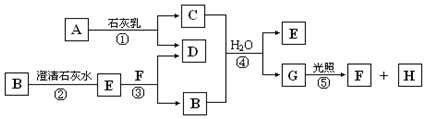 图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).
图中A~H均为中学化学中常见的物质,A、B、H是气体,它们之间有如图转化关系(反应中生成的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强,活化分子数增加,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增加,化学反应速率一定增大 | |
| C. | 加入反应物,使活化分子百分数增加,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能、反应速率加快,但是活化分子百分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com