
| A. | 放电时CH3OH参与反应的电极为正极 | |
| B. | 充电时电解质溶液的pH逐渐增大 | |
| C. | 放电时负极的电极反应为:2CH3OH-12e-+16OH-═2CO32-+12H2O | |
| D. | 充电时每生成1 mol CH3OH转移6 mol电子 |
分析 放电时,相当于原电池的工作原理,正极上氧气发生得电子的还原反应,负极甲醇发生失电子的氧化反应;充电时,相当于电解池的工作原理,根据反应方程式来确定溶液的酸碱性并判断电子转移的量.
解答 解:A、放电时,相当于原电池的工作原理,负极发生失电子的氧化反应,根据总反应可知,放电时CH3OH失电子,在负极上反应,故A错误;
B、充电时,相当于电解池的工作原理,根据总反应:2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O,生成大量的氢氧根离子,所以碱性增强,故电解质溶液的pH逐渐增大,故B正确;
C、放电时负极发生失电子的氧化反应,根据总反应:2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O,则负极的电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O,故C正确;
D、充电时,根据总反应:2CH3OH+3O2+4OH-$?_{充电}^{放电}$ 2CO32-+6H2O,每生成2molCH3OH转移12mol电子,则每生成1molCH3OH转移6mol电子,故D正确.
故选A.
点评 本题考查了化学电源新型电池,明确元素的化合价变化、氧化还原反应与原电池反应的关系是解答本题的关系,知道阴、阳极正好是原电池的负极、正极上反应的逆反应,为易错点.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Na+>N3->H+ | |
| B. | 氢铝化合物与水反应生成氢氧化铝和氢气 | |
| C. | 与盐酸反应都只生成一种盐 | |
| D. | 与水反应都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ①③④⑥ | C. | ①②③④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 误将洁厕灵与消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 向100mL0.1mol/L FeBr2溶液中通入0.0125mol Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 高锰酸钾酸性溶液吸收二氧化硫:SO2+MnO4-+4H+═SO42-+Mn2++2H2O | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++SO42-+Ba2++4OH-═BaSO4↓+[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
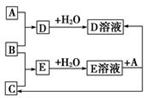 已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.
已知A、B、C为中学化学中常见的单质.室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④①③ | B. | ③④①② | C. | ①②④③ | D. | ②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
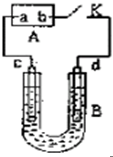 如图,A为直流电源,B为电解槽,c、d为石墨电极,B中存放有100mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的量浓度为0.1mol/L,闭合K,d极收集到标准状况下448mL的一种气体甲,该气体能使湿润的碘化钾淀粉试纸变蓝.气体体积均在标准状况下测定,假设溶液的体积变化忽略不计,不考虑电解产生的气体溶解和吸收.请回答下列问题.
如图,A为直流电源,B为电解槽,c、d为石墨电极,B中存放有100mL NaCl和CuCl2的混合溶液,其中Cu2+的物质的量浓度为0.1mol/L,闭合K,d极收集到标准状况下448mL的一种气体甲,该气体能使湿润的碘化钾淀粉试纸变蓝.气体体积均在标准状况下测定,假设溶液的体积变化忽略不计,不考虑电解产生的气体溶解和吸收.请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com