
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
. 分析 根据元素在周期表中位置知,①②③④⑤⑥⑦⑧⑨⑩分别是Na、K、Mg、Ca、Al、C、F、Cl、Br、Ar元素,
(1)稀有气体元素最不活泼;同一周期中,元素的金属性随着原子序数的增大而减弱,同一主族中,元素的金属性随着原子序数的增大而增强;
(2)金属性越强,最高价氧化物对应水合物的碱性越强;
(3)电子层数越多,离子半径越大,电子层结构相同的离子,离子半径随着原子序数的增大而减小;
(4)钠与溴结合形成溴化钠;灼烧溴化钠呈现黄色;溴化钠溶液与氯气反应生成氯化钠和溴单质;
(5)第三周期元素中金属性最强的元素为和非金属性最强的元素分别为Na、Cl,二者形成的化合物为NaCl,NaCl为离子化合物,用电子式表示出氯化钠的形成过程.
解答 解:根据元素在周期表中位置知,①②③④⑤⑥⑦⑧⑨⑩分别是Na、K、Mg、Ca、Al、C、F、Cl、Br、Ar元素,
(1)这几种元素中最不活泼的是Ar元素,金属性最强是元素是K,
故答案为:Ar;K;
(2)①、③、⑤分别为Na、Mg、Al,同一周期中,原子序数依次增大,金属性依次减弱,则金属性最强最强的为Na,Na的最高价氧化物对应水合物为NaOH,
故答案为:NaOH;
(3)②、③、④分别为K、Mg、Ca,对应离子分别为钾离子、镁离子、钙离子,镁离子的电子层最少,其离子半径最小,钾离子的核电荷数较小,则钾离子半径最大,所以离子半径大小为:K+>Ca2+>Mg2+,
故答案为:K+>Ca2+>Mg2+;
(4)①和⑨分别为Na、Br,二者形成化合物为NaBr,NaBr中含有钠元素,在灼烧时的焰色为黄色;元素⑧的单质为氯气,溴化钠溶液与氯气反应生成氯化钠和溴,反应的离子方程式为:Cl2+2 Br-=2Cl-+Br2,
故答案为NaBr;黄;Cl2+2 Br-=2Cl-+Br2;
(5)第三周期元素中金属性最强的元素为和非金属性最强的元素分别为Na、Cl,二者形成的化合物为NaCl,NaCl为离子化合物,书写电子式时注意,左边写钠原子和氯原子电子式,右边写氯化钠的电子式,中间用箭头连接,用电子式表示氯化钠的形成过程为: ,
,
故答案为: .
.
点评 本题考查了位置、结构与性质的关系及应用,题目难度中等,涉及离子方程式书写、电子式、离子半径大小比较、元素周期律应用等知识,明确元素周期表结构、元素周期律内容为解答关键,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液(BaCl2) | B. | FeCl2溶液(KSCN) | ||
| C. | 海带灰过滤所得的溶液(淀粉溶液) | D. | NaOH溶液(CaCl2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+═H2O+BaCO3↓ | |
| B. | 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 钠与CuSO4溶液反应:2Na+Cu2+═Cu↓+2Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 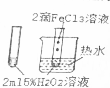 验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 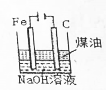 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. |  验证盐酸、碳酸、苯酚酸性的强弱 | |
| D. |  制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离、提纯→确定化学式→确定最简式→确定结构式 | |
| B. | 分离、提纯→确定最简式→确定化学式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定最简式→确定化学式 | |
| D. | 确定化学式→确定最简式→确定结构式→分离、提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
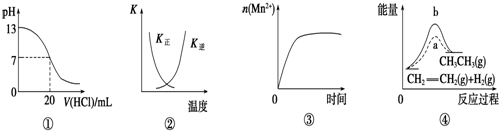
| A. | 图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol/L KMnO4酸性溶液与过量的0.1 mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应:CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的总能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 100ml 0.1mol/LCH3COOH溶液跟足量锌反应,生成的氢气分子数为0.01NA | |
| C. | 0.1mol CH4所含质子数为NA | |
| D. | 0.5mol C2H4中含有的C=C双键数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com