
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.高压比常压更有利于 SO2 转化为 SO3
C.蒸干 AlCl3 溶液无法得到无水 AlCl3
D.滴加少量 CuSO4 溶液可以加快 Zn 与稀 H2SO4 反应的速率
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室制备气体和验证气体性质的装置图。
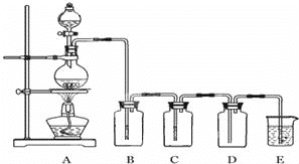
若利用如图装置实现碳和浓硫酸的反应,并进行如下验证:
①装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则D装置中品红溶液的作用是______,证明气体中有CO2的现象是______。
②若证明SO2具有氧化性,同时证明碳酸的酸性比硅酸的强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。
则:B中的现象______,E中应加入______溶液,E中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲苯苯环上的氢原子被相对分子质量为43的烃基取代,所得一元取代物有_________ 种。
(2)已知二氯苯有3种同分异构体,则四氯苯的同分异构体数目有________种。
(3)某芳香烃的分子式为C8H10,它不能使溴水褪色,但能使酸性KMnO4溶液褪色,该有机物苯环上的一氯代物只有一种,则该烃的结构简式是_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,11.2LCO和CO2混合气体质量为20.4g,下列说法正确的是( )
A.混合气体中CO和CO2的体积比1∶4
B.混合气体中CO和CO2的体积比4∶1
C.混合气体中CO和CO2的质量比为1∶4
D.混合气体中CO和CO2的平均相对分子质量为40.8g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学。掌握实验方法以及完成化学实验所需要的技能,是学好化学的关键。
(1)正确使用仪器、按正确的步骤进行实验都是实验成功的关键。请回答:
①分液时,分液漏斗中的液体很难滴下,原因是:_____________________________。
②容量瓶使用之前,必须进行的操作为:___________________________。
③可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先________________。
(2)欲测定某铝铜合金的组成,进行了如下实验:称取粉末状样品1.0克,加入某浓度的盐酸10 mL ,充分反应后,收集到标准状况下气体224 mL ;然后,再往样品中加入同浓度的盐酸10 mL ,充分反应后又收集到标准状况下气体112 mL 。求:
①所取盐酸的物质的量浓度为________________。
②样品中铝的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在-100 ℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键)。下列说法正确的是

A.X既能使溴的四氯化碳溶液褪色,又能使酸性KMnO4溶液褪色
B.X是一种常温下能稳定存在的液态烃
C.X和乙烷类似,都容易发生取代反应
D.充分燃烧等质量的X和甲烷,X消耗氧气较多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上烟气脱氮的原理![]()
(1)该反应化学平衡常数K的表达式为____________。温度升高,K值___________(选填“增大”、“减小”、“不变”)。如果平衡常数K值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变 b.容器内气体的压强不变
c.反应消耗0.5mol NO的同时生成1mol N2 d.![]() 的浓度不变
的浓度不变
(3)向2 L密闭容器中加入反应物,10 min后达到平衡,测得平衡时气体的物质的量增加了0.2mol,则用![]() 表示的平均反应速率为__________。
表示的平均反应速率为__________。
(4)如图是P1压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为![]() 下NO的转化率随反应时间变化的示意图。
下NO的转化率随反应时间变化的示意图。
 ______
______
(5)工业合成氨的反应温度选择500℃左右的原因是_______________。
(6)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥![]() 。
。![]() 溶液显__________性;常温下将等体积等浓度的氨水和
溶液显__________性;常温下将等体积等浓度的氨水和![]() 溶液混合,pH>7,溶液中
溶液混合,pH>7,溶液中![]() 浓度由大到小的关系是_______________。
浓度由大到小的关系是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:25 ℃、101 kPa时,C(s)+1/2O2(g)=CO(g) ΔH1=-110.5 kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5 kJ/mol
试回答下列问题:
①碳的燃烧热是:__________(填“ΔH1”或“ΔH2”);
②CO(g)+1/2O2(g)=CO2(g) ΔH=__________kJ/mol。
(2)在25 ℃时,将0.2 mol NO2充入2 L的密闭容器中,发生反应:2NO2(g)![]() N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
N2O4(g) ΔH=-56.9 kJ/mol。5秒后反应达到平衡,测得NO2的物质的量为0.1 mol。试回答下列问题:
①5秒内,v(NO2)=__________mol/(L·s);
②若将该容器置于冰水中,气体颜色将________(填“变深”“变浅”或“不变”);
③该反应的平衡常数表达式K=________________。
(3)NaHSO3是中学化学常见的物质。HSO3-在水溶液中存在如下两个平衡:
HSO3-=H++SO32- Ka2
HSO3-+H2O=H2SO3+OH- Kh2
已知25 ℃时,Ka2>Kh2,则0.1 mol/L NaHSO3溶液:
①溶液呈__________(填“酸性”“碱性”或“中性”);
②溶液中c(Na+)______c(HSO3-)(填“>”“<”或“=”)。
(4)将除锈后的铁钉用饱和食盐水浸泡一下,放入下图所示的具支试管中。

①几分钟后,可观察到导管中的水柱________;
A.升高 B.降低
②水柱变化的原因是铁钉发生了电化学腐蚀中的________;
A.析氢腐蚀 B.吸氧腐蚀
③该电化学腐蚀的正极反应式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机化学中有一种“吉利分子”C8H8O8,“吉利分子”C8H8O8可由X经如图所示转化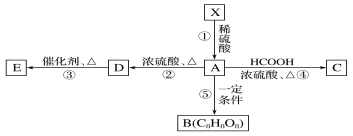
已知:①相同条件下,X与H2的相对密度为81,其中氧的质量分数约为49.4%,分子中氢、氧原子个数比为2∶1,X中没有支链;
②1 mol X在稀硫酸中发生反应生成2 mol甲醇和1 mol A;
③A中含有手性碳原子;
④D能使Br2的CCl4溶液褪色,E为高分子化合物,B为环状结构。
根据上述信息填空:
(1)X的分子式为______,A的分子中含有官能团的名称是______,E的结构简式为______;D若为纯净物,D的核磁共振氢谱存在________种吸收峰,面积比为________。
(2)写出B的一种含一个六元环的同分异构体的结构简式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com