
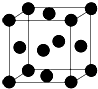
 用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g•cm-3,晶胞中该原子的配位数为12;Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm(阿伏加德罗常数为NA,列出计算表达式,不用化简).
用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如图),已知该晶体的密度为9.00g•cm-3,晶胞中该原子的配位数为12;Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm(阿伏加德罗常数为NA,列出计算表达式,不用化简). 分析 Cu的晶胞为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子位于面心上,每个顶点Cu原子为12个面共用,据此判断Cu的配位数;根据晶胞的结构图可知,晶胞中含有铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,根据晶胞的密度可求得晶胞的体积,进而求得晶胞的边长,在晶胞结构中,晶胞的面对角线等于Cu原子半径的4倍,据此可计算得铜原子的半径;
解答 解:Cu的晶胞为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子位于面心上,每个顶点Cu原子为12个面共用,所以Cu的配位数为12,根据晶胞的结构图可知,晶胞中含有铜原子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,设晶胞的边长为a cm,则a3•ρ•NA=4×64,所以a=$\root{3}{\frac{4×64}{ρ•{N}_{A}}}$,由于面对角线为$\sqrt{2}$a,面对角线的$\frac{1}{4}$为Cu原子半径,所以Cu原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8cm,
故答案为:12;$\frac{\sqrt{2}}{4}×\root{3}{\frac{4×64}{9.00×6.06×1{0}^{23}}}$cm=1.27×10-8.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,侧重考查了晶胞的结构和晶胞的计算,注意均摊法的应用,对学生的观察能力和空间想象能力有较高的要求,题目难度中等.


科目:高中化学 来源: 题型:解答题
 某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验按以下步骤进行:①称取ag样品,置于烧杯中;②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;④加入过量氨水,充分搅拌,使沉淀完全;⑤过滤,洗涤沉淀;⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;⑦…
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验按以下步骤进行:①称取ag样品,置于烧杯中;②加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;④加入过量氨水,充分搅拌,使沉淀完全;⑤过滤,洗涤沉淀;⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;⑦…查看答案和解析>>
科目:高中化学 来源: 题型:解答题
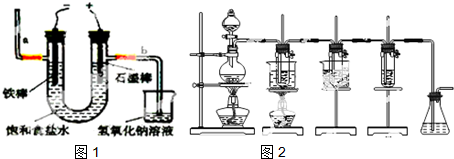
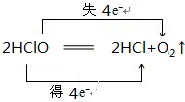 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LO2中含有的共键数为0.4NA | |
| B. | 0.1molH2S和0.1molSO2混合后,体系中的硫原子数0.2NA | |
| C. | 100g质量分数为16.2%HBr溶液中的氢原子数为NA | |
| D. | 3.9gNa2O2晶体中所含的离子总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Z两种元素可形成X2Z和X2Y2两种常见共价化合物 | |
| B. | 工业上常用电解熔融的W和M氯化物的方法分别制取W、M两种单质 | |
| C. | M的最高价氧化物与Y、W两元素最高价氧化物对应水化物均能反应生成盐和水 | |
| D. | X与W可形成离子化合物,且该离子化合物具有较强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com