

分析 绿矾加入水溶解,加入硫酸和过氧化氢氧化亚铁离子,再加入氢氧化钠和次氯酸钠氧化铁离子生成高铁酸钠溶液,过滤后得到滤液通过蒸发浓缩,冷却结晶过滤得到晶体加入饱和KOH溶液提供钾离子得到高铁酸钾晶体,过滤洗涤干燥得到产品高铁酸钾,
(1)FeSO4溶液中亚铁离子易被氧化生成铁离子,亚铁离子水解生成氢氧化亚铁,加入铁粉防止氧化,加入硫酸防止水解;
(2)过氧化氢受热易发生分解失去氧化作用;
(3)上述分析可知用饱和KOH溶液提供钾离子结晶高铁酸钾晶体;
(4)高铁酸钾不溶于乙醚,用乙醚作洗涤剂减少产品损失;
(5)假设所有反应均完全时产率最高,依据元素守恒分析计算;
(6)结合铁元素守恒分析计算;
(7)电解时阳极发生氧化反应,Fe在碱性条件下被氧化为FeO42-.
解答 解:(1)FeSO4溶液中亚铁离子易被氧化生成铁离子,亚铁离子水解生成氢氧化亚铁,加入铁粉防止氧化,加入硫酸防止水解,实验室配制FeSO4溶液时,需加入铁粉和稀硫酸,加稀硫酸原因是抑制FeSO4的水解,
故答案为:抑制FeSO4的水解;
(2)第一次氧化时,需要控制温度不超过35℃,原因是过氧化氢受热易发生分解失去氧化作用,
故答案为:温度过高H2O2会分解;
(3)上述分析可知用饱和KOH溶液提供钾离子结晶析出高铁酸钾晶体,用饱和KOH溶液结晶的原因是提供K+离子,
故答案为:提供K+;
(4)高铁酸钾不溶于乙醚,洗涤时用乙醚作洗涤剂的原因是用乙醚作洗涤剂减少产品损失,
故答案为:减少K2FeO4的损失;
(5)反应中Fe3+→FeO42-,铁元素化合价由+3价升高为+6价,化合价总升高3价,ClO-→Cl-,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故Fe3+系数为2,ClO-系数为3,由铁元素守恒可知 FeO42-系数为2,由氯元素守恒可知Cl-系数为3,根据钠元素守恒可知OH-系数为10,由氢元素守恒可知H2O系数为5,配平离子方程式:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5 H2O,假设所有反应均完全时产率最高,假设所有反应均完全时产率最高则n(FeSO4•7H2O):n(NaOH)理论值应为1:5,
故答案为:1:5;
(6)经测定第一、二次氧化时的转化率分别为a和b,结晶时的转化率为c,若要制备d Kg的K2FeO4,元素守恒得到铁元素物质的量$\frac{d}{198}$Kmol,设需要绿矾质量为xkg,则得到x×abc=$\frac{d}{198}$×278
则需要FeSO4•7H2O 质量=$\frac{278d}{198abc}$kg=$\frac{139d}{99abc}$kg,
故答案为:$\frac{139d}{99abc}$或$\frac{278d}{198abc}$;
(7)电解时阳极发生氧化反应,Fe在碱性条件下被氧化为FeO42-,电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O.
点评 本题考查了物质制备方法的分析,流程中试剂选择,产物判断,实验基本操作的目的和作用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)放出热量99kJ,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
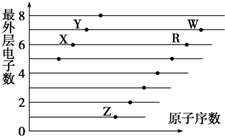
| A. | X和R在同一主族 | |
| B. | 含氧酸酸性:W>R | |
| C. | X与W可以形成酸性氧化物 | |
| D. | X、Z形成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03mol•L-1•s-1 | B. | 0.015mol•L-1•s-1 | ||
| C. | 0.12mol•L-1•s-1 | D. | 0.06mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com