
【题目】三室式电渗析法处理含NH4NO3废水的原理如图所示,工作一段时间后,在两极区均得到副产品NH4NO3。下列叙述错误的是( )

A.a极为电源负极,b极为电源正极
B.c膜是阳离子交换膜,d膜是阴离子交换膜
C.阳极电极反应式为4OH--4e-=O2↑+2H2O
D.Ⅱ室溶液的pH保持不变
【答案】D
【解析】
在直流电场的作用下,两膜中间的NH4+和NO3-可通过离子交换膜,工作一段时间后,在两极区均得到副产品NH4NO3,则NH4+向左移动,NO3-向右移动,在两极分别产生NH4NO3;在电解池中,阳离子向阴极移动,则与电源a电极连接的石墨为阴极,电极反应2H++2e-=H2↑,Ⅰ室中阳离子减少,NH4+移动到Ⅰ室与硝酸根,形成硝酸铵。a为电源负极,b为电源正极,与之相连的石墨为阳极,电极反应4OH--4e-=2H2O+O2↑,Ⅲ室中剩余较多NH4+,NO3-移动到Ⅰ室与铵根,形成硝酸铵据此分析判断。
A、分析可知a极为电源负极,b极为电源正极,故A正确;
B、工作一段时间后,在两极区均得到副产品NH4NO3,则NH4+向左移动,NO3-向右移动,在两极分别产生NH4NO3;所以c膜是阳离子交换膜,d膜是阴离子交换膜;故B正确;
C.根据分析可知阳极的电极反应式为:4OH--4e-=2H2O+O2↑,故C正确;
D.Ⅱ室中存在铵根的水解使溶液显酸性,随着铵根离子进入Ⅰ室,溶液酸性逐渐减弱,故D错误;
故答案为D。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() 2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8 mol,B的物质的量为0.6 mol,C的物质的量为0.8 mol。
(1)用C表示10 s内反应的平均反应速率为______________。
(2)反应前A的物质的量浓度是______________。
(3)10 s末,生成物D的浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制取SO2并验证SO2的某些性质的装置(夹持装置和加热装置已略,气密性已检验),请回答下列问题:
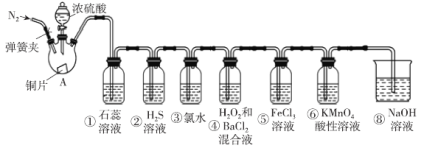
(1)在A中发生反应的化学方程式为___。
(2)①中的实验现象为紫色石蕊溶液___。
②中的实验现象为___,写出此化学反应方程式___。
③中的实验现象是___,写出此化学反应方程式___。
④中的实验现象是___,写出此化学反应方程式___。
⑤中的现象是溶液由黄色变为浅绿色,其反应的离子方程式为___。
(3)能体现出SO2还原性的实验序号是___。
(4)实验结束后需要通入N2,其目的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于焓变![]() 的叙述或判断正确的是
的叙述或判断正确的是![]()
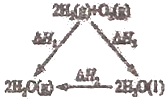
A.据如图可知:![]()
B.由![]() 可知,若将含1mol
可知,若将含1mol![]() 的稀溶液与含1molNaOH的稀溶液混合,放出的热量为
的稀溶液与含1molNaOH的稀溶液混合,放出的热量为![]()
C.![]() 、30MPa下,将
、30MPa下,将![]() 和
和![]() 置于密闭容器中充分反应,放出
置于密闭容器中充分反应,放出![]() 热量,则反应
热量,则反应![]() 的
的![]()
D.![]() 在常温下能自发进行,则该反应的
在常温下能自发进行,则该反应的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 在微生物作用的条件下,NH![]() 经过两步反应被氧化成NO
经过两步反应被氧化成NO![]() 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
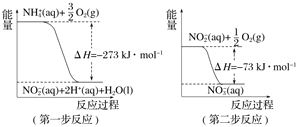
① 第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
② 1 mol NH![]() (aq)全部氧化成NO
(aq)全部氧化成NO![]() (aq)的热化学方程式是_______________________。
(aq)的热化学方程式是_______________________。
(2) 已知红磷比白磷稳定,则反应P4(白磷,s)+5O2(g)===2P2O5(s) ΔH1;4P(红磷,s)+5O2(g)===2P2O5(s) ΔH2;ΔH1和ΔH2的关系是ΔH1________ΔH2 (填“>”“<”或“=”)。
(3) 在298 K、101 kPa时,已知:2H2O(g)===O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)===2HCl(g) ΔH2
2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2之间的关系正确的是________。
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
(4) 已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1 ①
Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1 ②
O2(g) ΔH=-226 kJ·mol-1 ②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________________。
(5) 已知H2(g)+Br2(l)===2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断 裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的反应装置如下图所示,关于实验操作或叙述错误的是
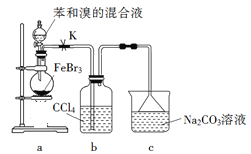
A. 向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B. 实验中装置b中的液体逐渐变为浅红色
C. 装置c中的碳酸钠溶液的作用是吸收溴化氢
D. 反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Ni原子核外有__种运动状态不同的电子,M层的电子云有__种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Se的第一电离能低于As,原因是___。
(3)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO2-中大π键应表示为__。
,则NO2-中大π键应表示为__。
(4)Mn3+在水溶液中容易歧化为MnO2和Mn2+,下列说法合理的是___。
A.Mn3+的价电子构型为3d4,不属于较稳定的电子构型
B.根据Mn2+的电子构型可知,Mn2+中不含成对电子
C.第四周期元素中,锰原子价电子层中未成对电子数最多
D.Mn2+与Fe3+具有相同的价电子构型,所以它们的化学性质相似
(5)FeO是离子晶体,其晶格能可通过图中的Born—Haber循环计算得到。
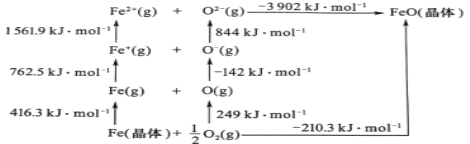
可知,O原子的第一电子亲和能为___kJmol-1,FeO晶格能为___kJmol-1。
(6)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。
),则d点的坐标参数为___,已知该晶体的密度为ρgcm-3,NA是阿伏加德罗常数的值,则晶胞参数为___pm。
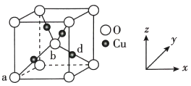
(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)根据题意选择以下四种物质的字母序号填空
A:Si B:Na2SiO3 C:Ca(ClO)2 D:KAl(SO4)2·12H2O
①漂白粉的有效成分是___。
②可用于制备硅胶和木材防火剂的是___。
③可用于制计算机芯片的是___。
④可用于作净水剂的是___。
(2)8.4gNaHCO3正好与20mL盐酸完全反应。此盐酸的物质的量浓度是___,产生的CO2在标准状况下的体积是___L。
(3)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①请用“单线桥”标明该反应电子转移的方向与数目___。
②该反应中氧化剂是___;当有1molNa2FeO4生成,转移的电子有___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
2E(g),若开始时只充入2mol E(g),达平衡时,E的转化率为40%;若开始时充入2mol M和1mol N的混合气体,达平衡时混合气体的压强比起始时减少了( )
A.20%B.40%C.60%D.80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com