
| A. | Mg2+ Na+ OH- | B. | Al3+ NO3- Cl- | ||
| C. | K+ H+ HCO3- | D. | Mg2+ Ca2+ SO42- |
分析 A.镁离子与氢氧根离子反应生成难溶物氢氧化镁;
B.三种离子之间不发生反应,能够共存;
C.碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
D.钙离子与硫酸根离子反应生成硫酸钙.
解答 解:A.Mg2+、OH-之间反应生成氢氧化镁沉淀,在溶液中不能大量共存,故A错误;
B.Al3+、NO3-Cl-之间不发生反应,在溶液中能够大量共存,故B正确;
C.H+、HCO3-之间发生反应,在溶液中不能大量共存,故C错误;
D.Ca2+、SO42-之间反应生成微溶物硫酸钙,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | SO2通入溴水中 | 溶液褪色 | SO2有还原性 |
| B | 将FeSO4样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | FeSO4样品已氧化变质 |
| C | 将新制氯水和KBr溶液在试管中混合后,加入苯酚,振荡静置 | 溶液分层,下层呈橙色 | 氧化性:Cl2>Br2 |
| D | 分别向0.1mol•L-1酸酸和饱和硼酸溶液中滴加0.1mol•L-1Na2CO3溶液 | 酸酸中有气泡产生,硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.
有10mL NaOH溶液,向其中通入一定量的CO2,得到了Na2CO3和NaHCO3的混合溶液.向所得溶液中逐滴加入0.1mol/L的盐酸,边加边振荡,使其充分反应,产生CO2气体的体积(标准状况)与所加盐酸体积之间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- | |
| B. | 能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3- | |
| D. | 能使淀粉KI试纸变蓝的溶液:K+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3用来制造耐高温的实验仪器 | |
| B. | Fe2O3常用作油漆和涂料 | |
| C. | 过氧化钠可以用作供氧剂、漂白剂等 | |
| D. | 熟石灰常直接用来治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 就地在田间焚烧秸秆,减少运输成本 | |
| B. | 烧煤进行脱硫、脱硝处理,减少空气污染 | |
| C. | 推广和鼓励多使用私家车出行 | |
| D. | 做好空气质量预报工作,以使污染程度高是好预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
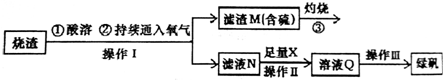
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol | |
| B. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol 水,放出57.3kJ热量 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com