
| A. | 0.5mol37Cl2和16g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 20g D2O和10g H2 | D. | 224mL D2和0.1mol N2 |
分析 A.质量转化为物质的量结合1个37Cl2含有34个电子,1个O2含有16个电子解答;
B.体积、质量转化为物质的量,结合1个 N2含有14个电子,1个CO2含有22个电子解答;
C.质量转化为物质的量,结合1个 D2O含有10个电子,1个H2含有2个电子解答;
D.D2气体状况未知,无法计算其物质的量和电子数.
解答 解:A.0.5mol37Cl2含有电子数为0.5×34=17mol,16g O2物质的量为$\frac{16g}{32g/mol}$=0.5mol,含有电子数为0.5×16=8mol,二者电子数不同,故A错误;
B.5.6L N2(标准状况),物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,含有电子数为0.25×14=3.5mol,11g CO2物质的量为$\frac{11g}{44g/mol}$=0.25mol,含有电子数为:0.25mol×22=5.5mol,二者电子数不同,故B错误;
C.20g D2O物质的量为$\frac{20g}{20g/mol}$=1mol,含有电子数为10mol,和10g H2物质的量为$\frac{10g}{2g/mol}$=5mol,含有电子数为5×2=10mol,二者电子数相等,故C正确;
D.D2气体状况未知,无法计算其物质的量和电子数,故D错误;
故选:C.
点评 本题主要考查了物质的量的相关计算,明确以物质的量为核心的计算公式,熟悉物质所含电子数多少是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 | B. | 2H2(g)+O2(g)+2H2O(l);△H=-484kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | D. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
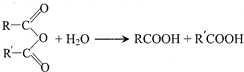
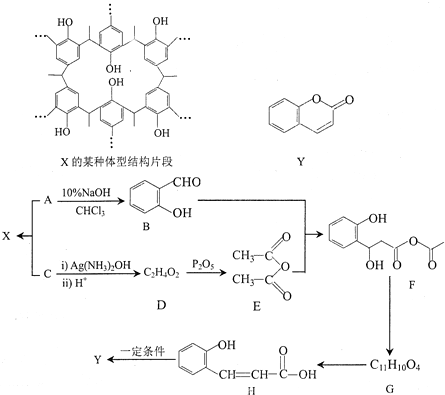
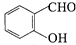 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基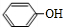 ,DCH3COOH,G
,DCH3COOH,G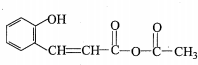

 )氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
)氮原子上的氢原子可以像A上的氢原子一样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式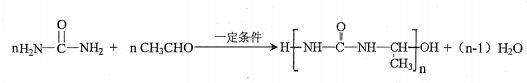
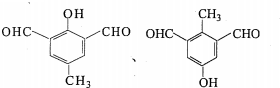 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程的离子方程式:2Cu2++3SO32-→Cu2O↓+SO42-+2SO2↑ | |
| B. | 反应过程的离子方程式:2Cu2++3SO32-+2H2O→Cu2O↓+SO42-+4H+ | |
| C. | 加入过量Na2SO3有利于控制溶液的pH | |
| D. | 在酸性条件下,若有14.4g Cu2O变质,转移电子0.02mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
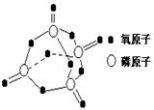 研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:
研究表明,化学反应的能量变化与反应物和生成物的键能有关.键能可以简单的理解为断开1mol 化学键时所需吸收的能量.下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
| A. | 434 | B. | 335 | C. | 237 | D. | 188 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3与Al(OH)3都能够作为治疗胃酸过多的药品 | |
| B. | 可以用铝制器皿盛放浓硫酸和浓氢氧化钠溶液 | |
| C. | 医院里用高锰酸钾溶液和双氧水来消毒,是因为两者有某种共同的性质 | |
| D. | 在水中投入适量的氢氧化钠固体可以增大明矾的净水效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com