
【题目】为测定已变质的过氧化钠的纯度,设计如下图所示的实验;Q为一具有良好的弹性气球,称取一定量的样品放于其中,按图安装的实验装置打开分液漏斗的活塞,将稀H2SO4滴入气球中.请填空:
(1)Q内发生反应生成种气体,其中的反应有个氧化还原反应.
(2)为测定反应生成气体的总体积,滴稀H2SO4前必须关闭(填K1、K2或K3 , 下同) , 打开 .
(3)当上述反应停止,将K1、K2、K3处于关闭状态,然后先打开K2 , 再缓缓打开K1 , 这时可观察到的现象是 .
(4)导管a的作用是 .
(5)b中装的固体试剂是 , 为何要缓缓打开K1 .
(6)实验结束时量筒I中有x mL水,量筒II中收集到y mL气体,则过氧化钠的纯度是(体积折算到标准状况).
【答案】
(1)2;1
(2)K1、K2;K3
(3)气球Q慢慢缩小
(4)平衡分液漏斗上下的压强使顺利流下
(5)碱石灰;控制气体流速,使CO2充分吸收
(6)![]()
【解析】解:(1)变质的过氧化钠中含有碳酸钠,加入酸后Q内发生反应:2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,前者的氧元素的化合价发生了变化,是氧化还原反应,后者元素的化合价未变,是非氧化还原反应,所以答案是:2;1;(2)反应产生的CO2、O2使气球变大,将广口瓶中气体排出,水进入量筒Ⅰ中,所以量筒Ⅰ中水的体积即为产生的CO2、O2的体积,所以滴稀H2SO4前必须关闭K1、K2打开K3 , 所以答案是:K1、K2;K3; (3)反应停止,打开K2 , 再缓缓打开K1 , 广口瓶内外相通,气球Q慢慢缩小,所以答案是:气球Q慢慢缩小;(4)为使分液漏斗内液体顺利流下,应是分液漏斗内外压强相等,所以导管a的作用是平衡分液漏斗上下的压强使顺利流下,所以答案是:平衡分液漏斗上下的压强使顺利流下;(5)混合气体通过碱石灰吸收CO2 , 最后量筒Ⅱ中收集的是O2 , 所以答案是:碱石灰;控制气体流速,使CO2充分吸收;(6)2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑; Na2CO3 +H2SO4=Na2SO4+H2O+CO2↑,![]() ×2
×2 ![]()
则过氧化钠的质量为: ![]() ×2×78,碳酸钠的质量为:
×2×78,碳酸钠的质量为: ![]() ×106,
×106,
所以过氧化钠的纯度: ![]() =
= ![]() ,所以答案是:
,所以答案是: ![]() .
.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯 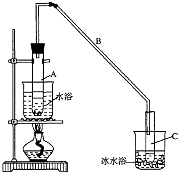
已知: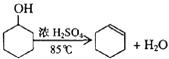
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,
缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静 置、分层,环己烯在上层,分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②实验制得的环己烯精品的质量往往低于理论产量,其可能的原因是
a.蒸馏时从100℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是 . a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下问题:
(1)下列说法不正确的是(填字母序号).
A.铝的氧化物属于碱性氧化物
B.光纤制品的基本原料为SiO2
C.用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化
D.液氨、液氯、液态氯化氢都是非电解质
E.丁达尔效应可用于区别溶液与胶体,云、雾均能产生丁达尔效应
F.化学变化前后原子的种类、数目不变,分子数目也不变
(2)出土的青铜器大多受到魂晶腐蚀,某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为采用“局部封闭法”可以防止青铜器进一步被腐蚀.如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(3)KNO3中NO3﹣的空间构型为 , 写出与NO3﹣互为等电子体的另一种阴离子的化学式:
(4)已知配合物CrCl36H2O中心原子Cr3+配位数为6,向含0.1molCrCl36H2O的溶液中滴加2mol/LAgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则该配离子的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物界在基本组成上的高度一致性表现在( )
①组成生物体的化学元素基本一致
②各种生物体的蛋白质都相同
③构成核酸的碱基都相同
④各种生物体的核酸都相同
⑤构成蛋白质的氨基酸都相同.
A. ①②④B. ①③⑤C. ②④⑤D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是过氧化氢(H2O2)分子的空间结构示意图。

(1)写出过氧化氢分子的电子式________。
(2)下列关于过氧化氢的说法中正确的是(填序号)______________。
①分子中有极性键 ②分子中有非极性键 ③氧原子的轨道发生了sp2杂化 ④O—O共价键是p—pσ键 ⑤分子是非极性分子
(3)过氧化氢分子之间易形成氢键,该氢键的表示式是____________。
(4)过氧化氢难溶于二硫化碳,主要原因是_________________;过氧化氢易溶于水,主要原因是_________________。
(5)过氧乙酸也是一种过氧化物,它可以看作是过氧化氢分子中的一个氢原子被乙酰基(CH3CO)取代的产物,是一种常用的杀菌消毒剂。在酸性条件下过氧乙酸易发生水解反应生成过氧化氢。
①写出过氧乙酸发生水解反应的化学方程式(有机物用结构简式表示):________________________。
②过氧乙酸用作杀菌消毒剂的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100mL﹣1).
Ⅰ.实验步骤
(1)用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到100mL(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.100 0molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如图所示,则此时的读数为 mL.![]()
(4)滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(5)Ⅱ.实验记录
滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论
按实验所得数据,可得c(市售白醋)=molL﹣1(列式计算);市售白醋总酸量=g100mL﹣1(列式计算).
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是填写序号).
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH﹣)增大
B.将NaOH和氨水溶液各稀释一倍,两者的OH﹣浓度均减少到原来的 ![]()
C.相同浓度的HCl和CH3COOH,两溶液中c(H+)相同
D.甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 ![]() 值减小
值减小
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选题)关于Al2O3下列说法正确的是( )
A.Al2O3可以通过分解反应和化合反应制得
B.Al2O3是两性氧化物
C.Al2O3薄膜非常致密,所以可用铝制容器盛放HCl溶液和NaOH溶液等
D.擦去表面氧化铝的铝条,在酒精灯上灼烧时,熔化的铝纷纷滴落下来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com