
将钠、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体的体积比为
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
下列有关电解质及氧化还原反应的叙述,正确的是( )
A.某化合物溶于水导电,则该化合物为电解质
B.NaCl溶液在电流作用下电离成Na+ 和Cl-
C.在氧化还原反应中,非金属单质一定是氧化剂
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
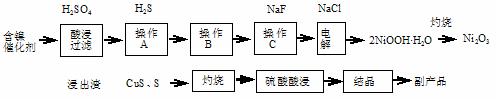
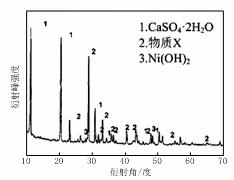
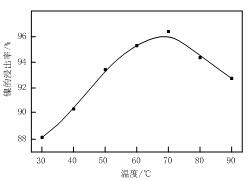
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素, 某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。该实验方案合理吗?若合理,请说明理由;若不合理,请加以改正。__________________________________________。
某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。该实验方案合理吗?若合理,请说明理由;若不合理,请加以改正。__________________________________________。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为 mol·L-1(常温时CaF2的溶度积常数为2.7×10-11)。抽滤装置中除了抽气泵、安全瓶外,还需要的主要仪器有_____________________。
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是五种短周期的主族元素,它们的原子序数依次增大,A、D都能与C按原子个数比为1:1或2:1形成化合物,A、B组成的气态化合物的水溶液呈碱性,E与C的最外层电子数相同。
(1)画出D的原子结构示意图 ,
(2)E元素在周期表中的位置是 。
(3)D与C按原子个数比为1:1的化合物的用途为 。
(4)B、C所形成氢化物的稳定性由强到弱的顺序是 (填具体的化学式)
(5)F是一种历史悠久、应用广泛的金属元素。若将F金属投入到盐酸溶液中,生成了浅绿色溶液M。写出M的酸性溶液和A与C形成的一种化合物X(化合物X中A、C原子个数比为1:1)反应的离子方程式: 。
(6)有人设想寻求合适的催化剂和电极材料,以A2、B2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式: ;放电时溶液中的H+移向 (填“正”或“负”)极。
(7)E(s) + O2(g) == EO2(g) △H1 ; E(g) + O2(g) === EO2(g) △H2 ;则△H1 △H2(填“>”或“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
将钠、镁、铝各0.3mol分别放入100mL1mol/L的盐酸中,同温同压下产生的气体的体积比为
A.1:2:3 B.6:3:2 C.3:1:1 D.1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
A.合金的熔点一般比组分金属低
B.铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na)
C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出
D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中,有时存在“一种物质过量,另一种物质仍不
能完全反应”的特殊情况。下列反应中属于这种情况的是 ( )
①过量的锌与18 mol/L的硫酸反应;
②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与块状石灰石反应。
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.含有离子键和共价键的化合物一定是离子化合物
B.元素原子的最外层电子数等于该元素的最高正化合价
C.目前人们已发现的元素种类数目与原子种类数目相同
D.多电子原子中,在离核较近的区域内运动的电子能量较高
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Na2CO3和NaHCO3的下列说法中正确的是( )
A.NaHCO3不如Na2CO3与盐酸反应剧烈
B.NaHCO3比Na2CO3稳定
C.石灰水能和NaHCO3反应,不与Na2CO3反应
D.等物质的量的Na2CO3和NaHCO3与足量盐酸反应,消耗HCl的物质的量之比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com