
设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
在一密闭容器中发生反应:2X(g)+Y(g)aZ(g) ΔH=Q kJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
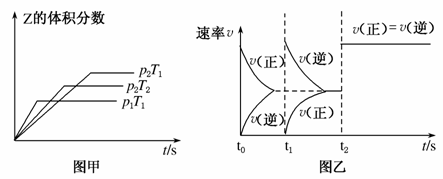
A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)===2CO(g)+O2(g)反应的
△H=+2×283.0kJ/mol
C.△H>0,△S>0,在任何温度下都不可自发进行。
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨厂所需H2可由焦炭与水反应制得,其中有一步反应为CO(g)+H2O(g)==CO2(g)+H2(g) △H<0欲提高CO转化率,可采用的方法是( )
①降低温度; ②增大压强; ③使用催化剂;④增大CO浓度; ⑤增大水蒸气浓度
A.①②③ B.④⑤ C.①⑤ D.⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(右图中的△H表示生成1mol产物的数据)。
(1)P和Cl2反应生成PCl3的热化学方程式_____________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________________,
(3)P和Cl2分两步反应生成1molPCl5的
△H3=_________,P和Cl2一步反应生成1molPCl5的△H4__________△H3 (填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中c(Cl-)最大的是( )
A 65mL1mol/L的KCl溶液 B 25mL3mol/L的NaCl溶液
C 20mL2mol/L的MgCl2溶液 D 10mL1.5mol/L的AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组拟设计如下图所示实验装置验证Ba(OH)2溶液和H2SO4溶液发生的是离子反应(夹持仪器略去)。
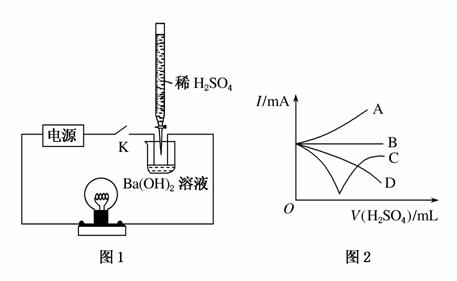
(1)该小组按图1连好装置后,接通开关K,旋转滴定管活塞使稀H2SO4缓缓滴下直至过量。图1装置中观察到的现象是______________________;能说明该反应是离子反应的依据是________。
(2)写出该反应的离子方程式____________________________。
(3)下列三种情况下,与(2)中离子方程式相同的是________。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO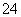 恰好完全沉淀
恰好完全沉淀
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(4)上述(1)整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图2中的________曲线表示。(填曲线对应字母)
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.某兴趣小组用如图装置做了两次实验。
实验①:向甲池的Pt电极表面通氢气,发现电流计指针发生了偏转,乙池的Pt电极表面出现气泡。
实验②:向乙池的Pt电极表面通氧气,发现电流计指针也发生了偏转,且偏转方向与实验①相同,同时甲池的Pt电极表面也出现气泡。

(1)实验①,甲池通氢气的Pt电极为________极,电极反应式为__________________________。
(2)实验②,乙池通氧气的Pt电极为________极,电极反应式为__________________________。
(3)两次实验中原电池的总反应相同,总反应的离子方程式为________________________________。
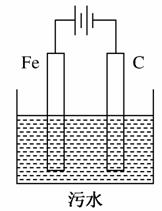
Ⅱ.电解 池污水处理技术已很成熟。富含悬浮物的工业污水采用如图装置进行处理:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,吸附部分悬浮物沉降,同时阴极产生的气泡将部分悬浮物带到水面形成浮渣层,然后滤去沉淀撇掉浮渣层。富含有机废物的生活污水也可用同样方法进行处理。污水中的有机废物能被阳极的某一产物迅速降解成二氧化碳、水等无机物。
池污水处理技术已很成熟。富含悬浮物的工业污水采用如图装置进行处理:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,吸附部分悬浮物沉降,同时阴极产生的气泡将部分悬浮物带到水面形成浮渣层,然后滤去沉淀撇掉浮渣层。富含有机废物的生活污水也可用同样方法进行处理。污水中的有机废物能被阳极的某一产物迅速降解成二氧化碳、水等无机物。
(1)电解处理过程中,若污水中离子浓度较小,导电能力较差,处理效率下降,此时可向污水中加入适量的________(填选项字母)。
A.BaSO4 B.CH3COOH
C.NaNO3 D.CH3OH
(2)电解处理过程中,阳极实际发生了两个电极反应,阳极的电极反应式分别是①______________________________;②__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com