
已知标准状况下:①6.72L CH4②3.01×1023HCl ③23.1g CCl4④2.3g Na,下列对四种物质的关系由小到大表示正确的是( )
|
| A. | 体积 ④<①<②<③ | B. | 密度 ①<④<③<② |
|
| C. | 原子数 ④<③<②<① | D. | 质量 ④<①<③<② |
| 阿伏加德罗定律及推论.. | |
| 分析: | 标况下,气体摩尔体积相等,①6.72L CH4的物质的量= |
| 解答: | 解:标况下,气体摩尔体积相等,①6.72L CH4的物质的量= A.根据V=nVm知,相同条件下,气体体积之比等于物质的量之比,所以其体积顺序是④<③<①<②,故A错误; B.ρ= C.根据N=nNA知,其分子数之比等于物质的量之比,分子数大小顺序是④<③<①<②,根据分子构成其原子个数大小顺序是,故C正确; D.甲烷质量=0.3mol×16g/mol=4.8g,HCl质量=0.5mol×36.5g/mol=18.25g,四氯化碳质量为23.1g,钠的质量是2.3g,所以其质量顺序是④<①<②<③,故D错误; 故选C. |
| 点评: | 本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,熟练掌握物质的量公式,题目难度中等. |


科目:高中化学 来源: 题型:
下列混合溶液中,加入过量的氨水产生沉淀,再加入过量的氢氧化钠溶液,沉淀消失的是( )
A.NaCl和MgCl2 B.NaNO3和KNO3
C.K2SO4和Al2(SO4)3 D.MgCl2和AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
烧瓶中放入铜片和稀硝酸,来制取较纯净的一氧化氮,反应开始后发现烧瓶中出现红棕色气体,这时的操作应是( )
A.立即接上收集容器,用向上排空气法收集
B.待烧瓶中红棕色气体消失后,用向上排空气法收集
C.待烧瓶中红棕色气体消失后,用排水法收集
D.立即用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法不正确的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH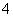 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯化铁溶液和氢氧化铁胶体的说法中,正确的是( )
|
| A. | 两种分散系均呈红褐色 | B. | 分散质粒子均能透过半透膜 |
|
| C. | 分散质粒子直径均在1﹣100nm之间 | D. | 可用丁达尔效应加以鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY2,则乙的分子式只可能是( )
|
| A. | XY | B. | X2Y | C. | X2Y3 | D. | X2Y5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在相应的条件下能大量共存的是( )
|
| A. | 在c(H+)/c(OH﹣)=1×10﹣14的溶液中:NH4+、Ca2+、Cl﹣、K+ |
|
| B. | 水电离的c(H+)=10﹣13mol•L﹣1的溶液中:Fe3+、SO42﹣、K+、SCN﹣ |
|
| C. | 在c(H+)=10﹣14mol/L的溶液中可能含:Na+,AlO22﹣,CO32﹣,SO32﹣ |
|
| D. | c(OH﹣)=1×10﹣14mol/L的溶液中:Na+、K+、Cl﹣、S2O32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究:
| 操作 | 现象 |
| 取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
|
| ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是________________________________。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是________。
(3)向水中持续通入SO2,未观察到白雾。推测现象ⅰ的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a的目的是________________________________ ________________________________________。
②由实验a、b不能判断白雾中含有HCl,理由是________________________________________________________________________________________________________________________________________________。
(4)现象ⅱ中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是__________________________________。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X。
①向沉淀X中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是________。
②用离子方程式解释现象ⅲ中黄绿色褪去的原因:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com