
分析 根据热化学方程式的书写及其注意事项可知,需注明物质的聚集状态、△H的正负号、数值、单位,燃烧热抓住1mol可燃物燃烧生成稳定氧化物、中和热抓住生成1mol水,且利用燃烧与中和反应放热来解答.
解答 解:①燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,故①错,改为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367.0 kJ/mol,
故答案为:错误,改为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1367.0 kJ/mol;
②热化学方程式的书写注明了物质的聚集状态、△H的正负号、数值、单位,故②正确,故答案为:正确;
③中和反应是放热反应,△H应小于0,故③错,改正NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,
故答案为:错误,NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol;
④方程式中未标注物质聚集状态,故④错误,改正2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol,
故答案为:错误,2CO(g)+O2(g)═2CO2(g)△H3=-566.0kJ/mol.
点评 本题考查燃烧热以及热化学方程式的书写正误判断,重在搞清书写热化学方程式的注意事项,题目难度中等.


科目:高中化学 来源: 题型:解答题
 A、B、C是中学化学中常见的单质,常温下甲、乙两种化合物分别是黑色固体和无色液体,这些化合物和单质之间有如图所示关系.据此判断:
A、B、C是中学化学中常见的单质,常温下甲、乙两种化合物分别是黑色固体和无色液体,这些化合物和单质之间有如图所示关系.据此判断:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 利用图1除去Cl2中的HCl | |
| B. | 利用图2由45°白酒制无水乙醇 | |
| C. | 利用图3检验产物中含有乙烯 | |
| D. | 图4是研究温度对NO2和N2O4平衡的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应A(g)+B(g)?nC(g)△H=x kJ•mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如右图.下列有关叙述一定正确的是( )
已知反应A(g)+B(g)?nC(g)△H=x kJ•mol-1,在不同条件下进行时,混合物中C的百分含量随时间变化的关系如右图.下列有关叙述一定正确的是( )| A. | a条件下的反应速率小于b条件下的反应速率 | |
| B. | 其他条件相同时,a表示有催化剂,b表示无催化剂 | |
| C. | 其他条件相同,若a、b表示不同压强下的反应,则n>2 | |
| D. | 其他条件相同,若a、b表示不同温度下的反应,则x>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

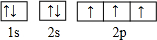 ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H20 | |
| B. | 碳酸钠溶液与少量盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| D. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+═Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反N2(g)+3H2(g)?2NH3(g),673K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a时正反应速率比逆反应速率小 | |
| B. | 点d:v正(H2)=3v逆(N2) | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 点c处反应达到平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com