
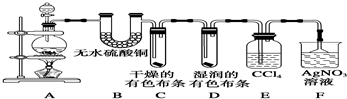
分析 实验室用加热浓盐酸与二氧化锰方法制取氯气,浓盐酸易挥发,所以制取的氯气中含有水蒸气和氯化氢,水蒸气能够与硫酸铜反应生成蓝色的五水硫酸铜,氯气与水反应生成具有漂白性的次氯酸,为检验氯化氢的存在通常用硝酸银溶液,注意排除氯气的干扰,可以用四氯化碳吸收氯气,据此分析解答.
(1)硫酸铜吸水生成蓝色硫酸铜晶体,检验是否含有水蒸气;四氯化碳能够吸收氯气,排除对氯化氢的干扰;
(2)依据次氯酸具有漂白性,氯气不具有漂白性解答;
(3)氯化氢能够与硝酸银反应生成氯化银沉淀,据此检验氯化氢存在,氯化氢易溶于水,吸收时应注意防止倒吸的发生.
解答 解:验证Cl2中含有有水蒸气和HCl,装置A验证水,装置B吸收水,装置C和D验证Cl2的性质,装置E除Cl2,装置F验证HCl溶于水生成的Cl-.
(1)无水硫酸铜吸水能生成蓝色五水硫酸铜晶体,检验是否含有水蒸气;四氯化碳能够吸收氯气,排除对氯化氢的干扰;
故答案为:验证水蒸气;吸收氯气,排除对氯化氢的干扰;
(2)从B中出来的氯气为干燥氯气不具有漂白性,所以C中布条不褪色,氯气进入D中遇到湿润的有色布条,生成次氯酸,次氯酸具有漂白性,所以看到有色布条褪色;
故答案为:有色布条不褪色;有色布条褪色;
(3)氯化氢能够与硝酸银反应生成氯化银沉淀,据此检验氯化氢存在,氯化氢易溶于水,吸收时应注意防止倒吸的发生;
故答案为:检验氯化氢;防止倒吸.
点评 本题考查了氯气的制备及净化,明确制备原理及杂质性质是解题关键,题目难度不大,注意实验设计严密性:检验氯化氢应排除氯气的干扰.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定低于M的,Y的能量一定低于N的 | |
| B. | 因为该反应为吸热反应,所以一定要加热反应才能进行 | |
| C. | 断裂反应物中的化学键吸收的能量小于形成生成物中的化学键放出的能量 | |
| D. | 反应物X和Y的总能量一定小于生成物M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
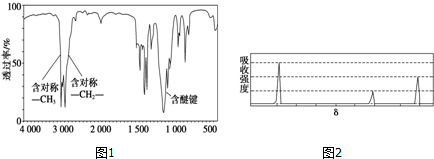
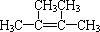 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水电离方程式为:NH3•H2O=NH4++OH- | |
| B. | 溶液中有:c(NH4+)+c(H+)=c(OH-) | |
| C. | 溶液中:c(NH3•H2O)=0.1mol/L | |
| D. | 加入少量NaOH固体,溶液中碱性增强,c(H+)•c(OH-)的乘积将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向品红溶液中滴加亚硫酸 | |
| B. | KMnO4溶液滴定NaHSO3溶液,溶液由无色变为浅红色30s不褪色,即为滴定终点 | |
| C. | 久置氯水变成无色 | |
| D. | 向苯酚溶液中滴加FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液质量减轻 | |
| B. | Fe3+的氧化性大于Cu2+ | |
| C. | 溶液中Cu2+与Fe2+的物质的量比为1:1 | |
| D. | 1 mol Fe可还原2 mol Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 甲 | 乙 | 丙 |
| 柚子 | 黄瓜 | 脐橙 |
| HOCH2COOH | C3H4O5 |  |
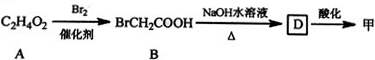
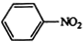 $\stackrel{Fe,HCl}{→}$
$\stackrel{Fe,HCl}{→}$ $→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$
$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$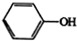
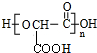 +(n-1)H2O.
+(n-1)H2O.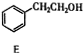 $\stackrel{经两步}{→}$
$\stackrel{经两步}{→}$ $→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J
$→_{(2)H+,△}^{(1)Fe,HCl}$$\stackrel{{C}_{8}{H}_{11}NO}{H}$$→_{(2)H_{2}O,H+,△}^{(1)NaNO_{2},HCl}$J查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com